
Análisis integral de la producción de alulosa: revisión y actualización
Allulose StoreFuente: mdpi.com
17 de agosto de 2024
1. Departamento de Ciencia y Tecnología de Cereales, Universidad de Ciencia y Tecnología de Jiangsu, Zhenjiang 212100, China
2. Centro de Investigación de Ingeniería de Bioprocesamiento de Granos de la Provincia de Jiangsu, Zhenjiang 212100, China
3. Departamento de Ciencias de la Computación, Universidad de Ciencia y Tecnología de Jiangsu, Zhenjiang 212100, China
En los últimos años se han producido avances significativos en la producción de D-alulosa, especialmente en lo que respecta a los métodos de conversión enzimática.
Los avances clave incluyen técnicas de inmovilización tradicionales, descubrimiento de nuevas enzimas, estudios de evolución dirigida y biosíntesis mediante modificación de vías metabólicas.
La conversión enzimática, especialmente mediante D-alulosa-3-epimerasa, sigue siendo esencial para la producción a escala industrial.
Las estrategias de inmovilización innovadoras, como las nanoperlas funcionalizadas y las nanopartículas MOF magnéticas, han mejorado significativamente la estabilidad y la reutilización de las enzimas.
La evolución dirigida ha llevado a mejoras en la termoestabilidad y la eficiencia catalítica de las enzimas, mientras que los métodos de biología sintética, incluidas las vías impulsadas por la fosforilación y la termodinámica, han optimizado los procesos de producción.
Los métodos de detección de alto rendimiento han sido clave para identificar y refinar variantes de enzimas para aplicaciones industriales.
En conjunto, estos avances no sólo aumentan la eficiencia de la producción y la rentabilidad, sino que también se alinean con prácticas de fabricación sostenibles y económicamente viables.
Los últimos cinco años han sido testigos de avances críticos que podrían tener un impacto potencial significativo en la viabilidad comercial y la demanda mundial de alulosa.
1. Introducción
La alulosa, también conocida como psicosa, es un azúcar raro que ha ganado gran interés en todo el mundo debido a su bajo contenido calórico y sus potenciales beneficios para la salud, particularmente en el tratamiento de la diabetes y la obesidad.
La creciente conciencia de los consumidores sobre los hábitos alimentarios saludables ha incrementado significativamente la demanda mundial de alulosa [ 1 , 2 , 3 , 4 ].
América del Norte, especialmente Estados Unidos, es líder en producción y desarrollo tecnológico, con empresas como Ingredion y Tate & Lyle.
La proliferación de alulosa en diversos productos alimenticios y bebidas ha sido fuerte, lo que ha acelerado aún más la demanda [ 5 ].
Además de Estados Unidos, Japón y Corea del Sur también son mercados importantes, con empresas como Matsutani Chemical y CJ CheilJedang pioneras en la producción y aplicación de alulosa [ 6 ].
La producción de alulosa requiere tecnologías sofisticadas, principalmente conversión enzimática y biología sintética [ 7 , 8 , 9 , 10 ].
La conversión enzimática , que utiliza enzimas específicas para convertir la fructosa en alulosa, es ampliamente preferida debido a su alto rendimiento y eficiencia.
La enzima D-alulosa-3-epimerasa está involucrada en la conversión de fructosa en alulosa, lo que cambia la configuración del grupo hidroxilo en el tercer átomo de carbono de la fructosa, dando como resultado alulosa ( Figura 1 ) [ 11 , 12 ].
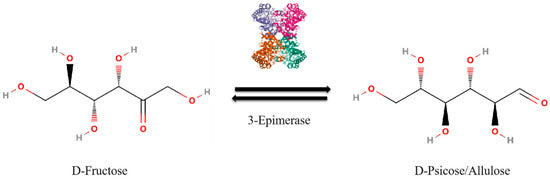
La tasa de conversión de fructosa en alulosa se mantiene alrededor del 30% debido al equilibrio termodinámico.
En la reacción enzimática catalizada por la D-alulosa-3-epimerasa, las reacciones directa (fructosa a alulosa) e inversa (alulosa a fructosa) alcanzan el equilibrio y se estabilizan en esta relación [ 13 , 14 , 15 , 16 , 17 , 18 ].
Este equilibrio refleja el panorama de energía libre de la reacción, donde la diferencia de energía entre la fructosa y la alulosa es mínima. Por lo tanto, en el equilibrio, las velocidades de reacción directa e inversa son iguales, lo que limita la conversión posterior [14, 19, 20, 21, 22, 23].
Para superar este obstáculo, se necesitan enfoques innovadores para inclinar la balanza hacia mayores rendimientos de alulosa.
La biología sintética ofrece una solución prometedora para esta barrera de equilibrio. Mediante la modificación genética de microorganismos para optimizar las vías metabólicas, se puede aumentar la eficiencia del proceso de transformación.
Este enfoque puede desplazar el equilibrio hacia mayores rendimientos de alulosa, superando los límites termodinámicos naturales [ 8 , 24 , 25 , 26 ].

- Figura 1. Representación esquemática de la reacción donde la D-fructosa se convierte en D-alulosa en presencia de 3-epimerasa.
Se han logrado avances significativos en el entorno regulatorio de la alulosa.
En 2019, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) reconoció a la alulosa como una sustancia generalmente reconocida como segura (GRAS), acelerando su penetración en el mercado [ 27 ].
A empresas como Ingredion y Tate & Lyle se les ha concedido el estatus GRAS, lo que permite una amplia distribución en los Estados Unidos.
La Autoridad Europea de Seguridad Alimentaria (AESA) también está evaluando el uso de alulosa en la Unión Europea, y datos recientes sugieren un resultado positivo [ 24 ].
China se está convirtiendo en un actor cada vez más importante en el mercado de la alulosa, centrándose en reducir el consumo de azúcar y mejorar la salud pública. Las empresas chinas están invirtiendo fuertemente en tecnologías de producción avanzadas y ampliando su capacidad para satisfacer la demanda nacional e internacional.
Baolingbao Biology Co., Ltd. (Yucheng, China) tiene una capacidad de producción de 5.000 toneladas por año, mientras que Shandong Sanyuan Biotechnology y CJ CheilJedang (Bingzhou, China) contribuyen significativamente con capacidades de 3.500 y 4.000 toneladas por año, respectivamente.
Estas inversiones multimillonarias resaltan su compromiso de satisfacer la creciente demanda de alulosa.
El apoyo regulatorio ha sido crucial en China. La Comisión Nacional de Salud (NHC) de China aprobó la alulosa como nuevo ingrediente alimentario en 2020, lo que facilitó su incorporación a una gama más amplia de alimentos [ 28 ].
Se espera que este apoyo regulatorio, combinado con la creciente capacidad de producción de China, reduzca significativamente los costos de producción y contribuya más significativamente a la salud humana al proporcionar una alternativa escasa al azúcar.
Por lo tanto, es necesario revisar los últimos logros en la tecnología y la investigación de producción de alulosa [ 6 , 17 , 29 , 30 , 31 , 32 , 33 ].
2. Últimos resultados
2.1. Transformación enzimática
La D-alulosa-3-epimerasa debe analizarse desde cuatro perspectivas diferentes: (1) métodos tradicionales que implican inmovilización y catálisis fijada a células completas para la producción a gran escala, (2) descubrimiento de nuevas enzimas, (3) estudios de evolución dirigida, y (4) biosíntesis mediante modificación de vías metabólicas. La conversión enzimática sigue siendo una tecnología fundamental para la producción de alulosa, especialmente la isomerización de fructosa a alulosa mediante enzimas específicas como la D-alulosa-3-epimerasa.
Debido a la expansión gradual de la demanda del mercado, la identificación de nuevas enzimas 3-epimerasas y la aplicación de métodos de inmovilización y biología sintética son estrategias cruciales para el desarrollo de los procesos industriales actuales. En este artículo, actualizamos los resultados de investigación de los últimos cinco años, centrándonos en la optimización de la actividad y la estabilidad de las enzimas para aumentar la eficiencia de conversión ( Tabla 1 ) [8, 11, 34, 35].
2.1.1. Grabación
El alginato de sodio, como método de inmovilización de grado alimenticio, se utiliza ampliamente en la producción actual de alulosa, pero constantemente surgen nuevos métodos que representan avances significativos en la estabilización y eficiencia de las enzimas [ 36 ].
Por ejemplo, un estudio que investigó la biotransformación de D-alulosa a partir de D-glucosa, que incluyó separación por cromatografía de lecho móvil simulado (SMBC) y purificación por cristalización, demostró una impresionante D-alulosa pura al 98% con un rendimiento del 70% [ 12 ].
Este proceso integrado aprovecha la alta selectividad del SMBC para separar eficientemente la D-alulosa de la mezcla de reacción, seguido de una cristalización para lograr una alta pureza.
La capacidad de lograr una pureza y un rendimiento tan elevados hace que este proceso sea muy atractivo para la producción a escala industrial, garantizando una conversión y separación eficientes.
Se observa otra innovación en la aplicación de nanoperlas de polihidroxialcanoato (PHA) funcionalizadas como biocatalizadores estables.
Estas nanoperlas fueron diseñadas para inmovilizar la D-alulosa-3-epimerasa, lo que mejora la estabilidad y la reutilización de la enzima.
En concreto, la enzima inmovilizada en nanoperlas de PHA conservó el 85% de su actividad inicial después de 10 ciclos de uso, en comparación con la enzima libre, que perdió el 50% de su actividad después de sólo 5 ciclos.
Esta mejora significativa en estabilidad y reutilización reduce los costos de producción y hace que el proceso sea más sostenible. Las nanoesferas de PHA funcionalizadas proporcionan una plataforma duradera que minimiza la degradación enzimática, lo que permite un uso a largo plazo en procesos industriales.
Además, la biosíntesis de dos pasos de D-alulosa a través de una cascada multienzimática para la bioconversión de jugos de frutas demostró la posibilidad de combinar múltiples enzimas en un solo proceso [37].
Este método implicó el uso secuencial de fructosa isomerasa y D-alulosa-3-epimerasa, lo que mejoró la eficiencia general y el rendimiento de la producción de D-alulosa.
El estudio informó una tasa de conversión del 75% de D-fructosa a D-alulosa, con un rendimiento total del 60% del sustrato de jugo inicial.
Este eficiente proceso de conversión es particularmente ventajoso cuando se utilizan sustratos complejos, como jugos de frutas, al optimizar cada paso de la conversión enzimática.
Al utilizar una cascada multienzimática, este enfoque proporciona mayores rendimientos generales y reduce la necesidad de pasos de procesamiento adicionales, simplificando así el proceso de producción.
Finalmente, la inmovilización de D-alulosa-3-epimerasa en nanopartículas con estructura metalorgánica magnética (MOF) representa un enfoque de vanguardia para la inmovilización de enzimas [ 38 ].
Estas nanopartículas magnéticas MOF permitieron una fácil recuperación y reutilización de la enzima, aumentando significativamente la eficiencia del proceso biocatalítico.
El estudio mostró que la enzima inmovilizada retuvo el 90% de su actividad después de 15 ciclos, en comparación con la enzima libre, cuya actividad cayó al 40% después del mismo número de ciclos.
Además, las nanopartículas MOF proporcionaron una gran superficie para la inmovilización de la enzima, mejorando la estabilidad y la actividad de la enzima.
Las propiedades magnéticas de las nanopartículas facilitaron su sencilla separación de la mezcla de reacción mediante un campo magnético, lo que hizo que el proceso fuera extremadamente práctico para la biocatálisis a gran escala.
Este método innovador no solo mejora el rendimiento de las enzimas, sino que también simplifica el procesamiento posterior, lo cual es fundamental para las aplicaciones industriales.
En conjunto, estos estudios resaltan avances significativos en las técnicas de inmovilización que mejoran la estabilidad de las enzimas, la reutilización y la eficiencia general en la producción de D-alulosa.
El uso de SMBC y cristalización proporciona alta pureza y rendimiento, lo que lo convierte en un método robusto para aplicaciones industriales.
Las nanoesferas de PHA funcionalizadas proporcionan una plataforma sostenible y rentable para la inmovilización de enzimas, lo que extiende la vida útil de las enzimas y reduce los costos.
El enfoque multienzimático en cascada optimiza el proceso de conversión, especialmente para sustratos complejos, lo que aumenta la eficiencia general de la producción. Las nanopartículas magnéticas MOF ofrecen una solución innovadora para la recuperación y reutilización de enzimas, mejorando tanto la estabilidad como la actividad.
En conjunto, estos métodos innovadores abren el camino hacia procesos industriales más sostenibles y rentables, contribuyendo en última instancia a la disponibilidad de alternativas de alulosa más saludables y haciendo avanzar el campo de la biotecnología industrial.
2.1.2. Prueba de nuevas enzimas industriales
Para descubrir nuevas enzimas industriales, numerosos estudios se han centrado en la caracterización y mejora de las D-alulosa-3-epimerasas, claves en la producción de azúcares raros. La D-alulosa-3-epimerasa recombinante de Agrobacterium sp. ATCC 31749 reveló un aminoácido interfacial crítico, Lys-152, esencial para la actividad catalítica y cuyas mutaciones reducen la actividad en un 70 %, lo que proporciona información valiosa para el diseño de enzimas [39].
Este hallazgo es crucial ya que proporciona una base para comprender cómo los residuos de aminoácidos individuales contribuyen a la función enzimática, guiando así los esfuerzos futuros para diseñar enzimas más eficientes y estables para aplicaciones industriales.
La supuesta dolicol fosfato manosa sintasa de Bacillus sp. mostró una tasa de conversión del 35% de D-fructosa a D-alulosa a 50 °C y mantuvo una actividad del 80% después de 24 h [ 40 ].
La doble funcionalidad de esta enzima, que exhibe actividad de D-alulosa 3-epimerasa y la capacidad de convertir D-fructosa en D-alulosa, podría simplificar los procesos de producción industrial al reducir la necesidad de múltiples enzimas. Esta estabilidad y eficiencia son clave en aplicaciones industriales donde los procesos de producción continuos son esenciales, ya que ofrece un potencial ahorro de costes y simplifica los flujos de trabajo de fabricación.
Otra D-alulosa-3-epimerasa de Bacillus sp. mostró una notable estabilidad térmica, con una vida media de 120 min a 70 °C, convirtiendo el 30 % de D-fructosa en D-alulosa a una temperatura óptima de 65 °C [ 10 ].
La capacidad de la enzima para funcionar eficazmente a altas temperaturas la hace especialmente adecuada para aplicaciones industriales donde la estabilidad térmica es crucial. Esta propiedad reduce la necesidad de sistemas de refrigeración, lo que reduce los costes energéticos y aumenta la eficiencia general del proceso de producción.
La tolerancia a altas temperaturas de la enzima también abre la posibilidad de su uso en procesos donde mantener temperaturas más bajas no sería práctico ni rentable.
Un nuevo gen de D-alulosa 3-epimerasa del metagenoma de un hábitat acuático termal, expresado en Bacillus subtilis, logró una tasa de conversión del 40% de D-fructosa a D-alulosa a 60 °C.
La enzima conservó el 75% de su actividad incluso después de 48 horas de funcionamiento continuo, lo que indica su robustez e idoneidad para uso industrial [ 13 ].
El uso de catálisis de células completas demuestra aún más la capacidad de la enzima para la producción escalable de D-alulosa, ofreciendo un método rentable y eficiente para producir este azúcar raro.
Este enfoque aprovecha la capacidad natural de las células enteras para realizar transformaciones bioquímicas complejas, simplificando el proceso de producción y reduciendo potencialmente los costos asociados con la purificación y estabilización de enzimas.
La D-tagatosa 3-epimerasa de Caballeronia fortuita mostró una amplia especificidad de sustrato, convirtiendo el 25% de D-fructosa en D-alulosa a 55 °C con una actividad de 1,2 U/mg de proteína [ 41 ].
La capacidad de producir una variedad de azúcares raros a partir de diferentes sustratos simplifica el proceso de producción y reduce los costos.
Esta versatilidad convierte a la enzima Caballeronia fortuita en una herramienta valiosa para las industrias que buscan producir alternativas de azúcar de alto valor de forma rentable. Su amplia gama de sustratos y su eficiencia en la conversión de múltiples azúcares resaltan su potencial para una amplia gama de aplicaciones industriales, incluyendo la producción de azúcares raros para las industrias alimentaria y farmacéutica.
La enzima de Christensenella minuta mostró una tasa de conversión del 32% a 50 °C con una vida media de 150 min, lo que destaca su potencial para la producción sostenible de azúcar [ 42 ].
La eficiencia y estabilidad de la enzima a temperaturas moderadas la hacen adecuada para diversas aplicaciones industriales, incluida la fabricación de alimentos y bebidas, donde se prefieren condiciones de procesamiento suaves para preservar la calidad del producto.
La robustez de la enzima en condiciones industriales prácticas sugiere que puede integrarse en los sistemas de producción existentes con una modificación mínima, aumentando la sostenibilidad y la eficiencia de los procesos de producción de azúcar.
Se utilizaron técnicas de evolución dirigida para mejorar la termoestabilidad de la D-alulosa 3-epimerasa H10 de Clostridium cellulolyticum [43].
La enzima mejorada aumentó su vida media de 30 min a 180 min a 65 °C y logró una tasa de conversión del 45 % de D-fructosa a D-alulosa.
Estas mejoras hacen que la enzima sea más viable para aplicaciones industriales, donde a menudo se requiere una estabilidad prolongada a altas temperaturas.
La aplicación de la evolución dirigida para mejorar las propiedades de las enzimas resalta el potencial de adaptar las enzimas a necesidades industriales específicas, optimizando así los procesos de producción.
Este enfoque resalta el poder de los métodos biotecnológicos modernos para crear enzimas con propiedades mejoradas adaptadas a aplicaciones industriales específicas.
La l-ribulosa-3-epimerasa hipertermoestable de Labedella endophytica conservó el 90% de su actividad después de 24 h a 80 °C, con una temperatura óptima de 75 °C [ 21 ].
La capacidad de la enzima para convertir el 28 % de D-fructosa en D-alulosa en estas condiciones subraya su potencial para procesos industriales de alta temperatura. Su robustez la convierte en una candidata prometedora para aplicaciones en condiciones extremas, como en la producción de ciertos productos químicos y farmacéuticos. Su alta termoestabilidad también permite su uso en procesos que requieren altas temperaturas sostenidas, lo que podría reducir la necesidad de etapas de enfriamiento y estabilización, lo que a su vez reduce los costos generales de producción.
La enzima Novibacillus thermophilus mostró una actividad óptima a 70 °C y retuvo el 85% de su actividad a esta temperatura después de 12 h [ 44 ].
Se logró una conversión del 38% de D-fructosa a D-alulosa, lo que demuestra su eficiencia en la síntesis de azúcar a escala industrial. La eficiencia y la estabilidad térmica de la enzima la hacen especialmente ventajosa para la producción de D-alulosa en procesos que requieren una actividad enzimática prolongada.
Un sistema de expresión de grado alimenticio en Corynebacterium glutamicum facilitó la conversión de melaza de caña a D-alulosa con una eficiencia de conversión del 42%, reteniendo el 80% de su actividad después de 24 h [ 36 ].
Este sistema mejora la producción y aplicación de la enzima en la industria alimentaria, proporcionando un método rentable y escalable para producir D-alulosa a partir de materias primas fácilmente disponibles, como la melaza. Esta innovación tiene importantes implicaciones para la industria alimentaria, donde existe una creciente demanda de alternativas más saludables a la alulosa.
Al utilizar un sistema de expresión de grado alimenticio, este enfoque garantiza que la D-alulosa producida cumpla con los estándares regulatorios y de seguridad para su uso en alimentos.
De manera similar, la D-tagatosa 3-epimerasa de Sinorhizobium sp. logró una tasa de conversión del 35% de D-fructosa a D-alulosa a 55 °C, conservando el 85% de su actividad después de 24 h [ 45 ]. El sólido desempeño de la enzima en estas condiciones sugiere su potencial para aplicaciones industriales, especialmente donde se requiere una operación continua.
Finalmente, la D-alulosa-3-epimerasa recombinante de Thermoclostridium caenicola mostró una tasa de conversión del 38% de D-fructosa a D-alulosa a 60 °C y retuvo el 80% de su actividad después de 24 h [ 22 ]. Juntas, estas enzimas muestran un potencial significativo para la integración en sistemas de producción a gran escala, donde su rendimiento consistente a largo plazo es esencial para mantener la eficiencia del proceso y reducir los costos, abriendo el camino para una aplicación más amplia de la D-alulosa en diversos productos.
En conjunto, estos estudios destacan avances significativos en la caracterización de enzimas, mejoras en la termoestabilidad y aplicaciones biocatalíticas eficientes que harán avanzar la producción industrial de D-alulosa y otros azúcares raros.
Al centrarse en enzimas con alta estabilidad y actividad en condiciones industriales, estos estudios conducirán a procesos de producción más eficientes y rentables, contribuyendo en última instancia a la disponibilidad de alternativas de alulosa más saludables.
Tabla 1. Investigaciones típicas recientes sobre las propiedades de la 3-epimerasa.
2.1.3. Estudio evolutivo directo
Los avances recientes en el desarrollo de la D-alulosa-3-epimerasa (DAEase) han mejorado su termoestabilidad, eficiencia catalítica y resistencia a los ácidos, que son cruciales para la producción industrial de D-alulosa [ 22 ].
El uso de la evolución dirigida —un método de mutación y selección iterativas— ha demostrado que las mutaciones de un solo aminoácido pueden mejorar significativamente las propiedades de una enzima. Cuando las mutaciones individuales fallan, las mutaciones neutrales suelen estabilizar la proteína, lo que permite cambios beneficiosos posteriores o modifica las funciones seleccionadas para desarrollar nuevas capacidades.
Este conocimiento de la evolución dirigida se aplicó a DAEase, lo que condujo a un mejor rendimiento de la enzima y a una producción industrial más eficiente y sostenible de D-alulosa baja en calorías [48].
A través de la evolución dirigida, los mutantes de la DAEasa H10 de Clostridium cellulolyticum, como D281G y C289R, mostraron una vida media significativamente mayor a 65 °C, y el mutante triple, A107P/D281G/C289R, aumentó la vida media en 58,85 veces y mejoró la termoestabilidad en 14,39 °C [ 43 ].
De manera similar, las herramientas computacionales identificaron mutaciones beneficiosas en la DAEasa de Thermoclostridium caenicola, lo que resultó en el mutante Var3 de cuatro puntos, que tiene mayor rigidez y estabilidad debido a nuevos enlaces de hidrógeno y una distribución de carga electrostática optimizada [ 49 ].
Un enfoque basado en la secuencia y la estructura identificó una TtDAE altamente termoestable de Thermogutta terrifontis, con la variante M4 teniendo un aumento de 5,12 veces en la eficiencia catalítica y una temperatura de fusión significativamente más alta [ 48 ]. Las sustituciones del aminoácido prolina en la DAEasa de Clostridium bolteae, particularmente el mutante doble Cb-51P/89P, llevaron a un aumento de 2,32 veces en la vida media a 55 °C [ 50 ].
Además, los esfuerzos de ingeniería para la resistencia al ácido dieron como resultado el triple mutante M3 (I114R/K123E/H209R), que aumentó su actividad en 3,36 veces y su resistencia al ácido en 10,6 veces a pH 4,5, haciéndolo adecuado para la producción de jugo funcional [ 51 ].
El diseño racional de la DAEasa de Halanaerobium congolense dio como resultado los mutantes Y7H/C66L/I108A y Y7H/C66L/I108A/R156C/K260C, el último de los cuales mostró una vida media de 5,2 h a 70 °C y un aumento de la temperatura de fusión de 6,5 °C [ 52 ].
Estos estudios resaltan la sinergia entre las predicciones computacionales y la validación experimental, revelando que mejorar la estabilidad y la actividad enzimática mediante modificaciones genéticas específicas es clave para las aplicaciones industriales. El uso de sustituciones de prolina y puentes disulfuro, combinado con el análisis del factor B, subraya la importancia de comprender la dinámica proteica para un diseño enzimático eficiente [53].
El desarrollo de variantes resistentes al ácido amplía aún más la aplicación de DAEase en entornos ácidos, lo que demuestra la versatilidad y el potencial de la enzima.
En general, estos esfuerzos de investigación abordan las limitaciones actuales de DAEase y establecen un precedente para futuros estudios destinados a optimizar aún más los biocatalizadores, allanando el camino en la biotecnología y más allá.
2.1.4. Método de biología sintética
La catálisis tradicional de células completas generalmente emplea Corynebacterium glutamicum o Bacillus subtilis modificados, y continuamente se exploran nuevas vías metabólicas [8].
Las investigaciones recientes sobre la participación del ATP en la catálisis metabólica son dignas de mención y podrían aportar cambios significativos a los métodos de biología sintética.
Los métodos de biología sintética pueden aumentar la tasa de conversión de la alulosa y alterar el equilibrio entre fructosa y alulosa. La producción de D-alulosa mediante biología sintética ha despertado un gran interés debido a sus beneficios para la salud y su valor económico. Esta revisión compara tres métodos destacados: la producción impulsada por fosforilación, la producción impulsada por termodinámica y el uso de Escherichia coli metabólicamente modificada, destacando sus vías integradas y su eficiencia [34].
La producción impulsada por fosforilación se caracteriza por su acoplamiento con el sistema de regeneración de ATP. En este método, la D-glucosa se convierte en D-alulosa mediante una serie de pasos enzimáticos. Las enzimas clave incluyen la hexoquinasa, que fosforila la D-glucosa a glucosa-6-fosfato, y la glucosa-6-fosfato isomerasa, que la convierte en fructosa-6-fosfato. La fructosa-6-fosfato es posteriormente convertida a alulosa-6-fosfato por la D-tagatosa-3-epimerasa, que finalmente se desfosforila a D-alulosa. El sistema de regeneración de ATP también involucra la creatina quinasa, que ayuda a mantener altos niveles de ATP, aumentando la eficiencia y el rendimiento del proceso de producción [54].
Una vía altamente eficiente para la síntesis de D-alulosa a partir de D-fructosa utiliza la D-psicosa epimerasa y la L-ramnulosa quinasa, que están integradas con un sistema de regeneración de ATP a través de la polifosfato quinasa (Figura 2) [55].
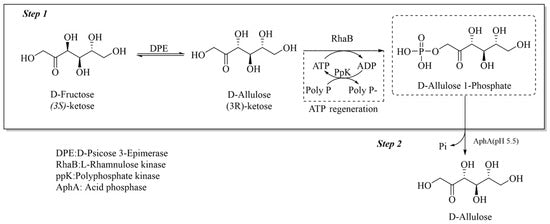
Este método logra una impresionante tasa de conversión del 99% al optimizar las condiciones de reacción clave, reducir significativamente el consumo de ATP al 10% de la cantidad teórica y emplear un régimen de dosificación por lotes para mitigar la inhibición del polifosfato.
Tradicionalmente, se ha utilizado ácido bórico para promover la reacción de síntesis de D-alulosa a través de complejos formados con fructosa, desplazando así el equilibrio hacia la producción de alulosa ( Figura 3 ).
Sin embargo, aunque el ácido bórico aumenta significativamente el rendimiento de conversión al explotar su alta afinidad de unión con la D-alulosa, plantea riesgos ambientales y para la salud debido a su toxicidad y la dificultad de eliminarlo del producto final.
Por el contrario, el enfoque enzimático explota la eficiencia catalítica natural de las enzimas y el ciclo de regeneración de ATP para promover de forma sostenible la reacción sin aditivos dañinos.
Este desarrollo destaca el potencial de la ingeniería metabólica para mejorar la eficiencia enzimática y la economía en la producción bioquímica. La integración exitosa de la regeneración de ATP no solo reduce costos, sino que también elimina la necesidad de ácido bórico, lo que hace que el proceso sea más ecológico [56].

Figura 2. Conversión de D-fructosa a D-alulosa por el método de fosforilación.
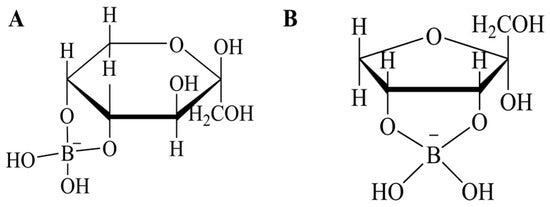
Figura 3. Estructuras químicas de los complejos azúcar-borato. (A) Fructosa como β-d-fructopiranosa cis-C-4,5 diol borato. (B) Psicosa como α-d-furanopsicosa cis-C-3,4 diol borato.
3. Resumen
Los avances tecnológicos en la producción de alulosa se centran no sólo en mejorar la eficiencia, sino también en abordar preocupaciones ambientales y económicas.
Los métodos de producción sostenibles, como el uso de materias primas renovables y los principios de la química verde, se integran en los procesos de producción. Por ejemplo, el uso de subproductos agrícolas como sustratos para la fermentación microbiana reduce los residuos y añade valor a materiales que, de otro modo, serían de bajo valor.
Los análisis económicos de estos métodos de producción avanzados han demostrado que optimizar el rendimiento de las enzimas y utilizar sistemas de producción integrados pueden reducir significativamente el costo de la producción de alulosa.
Estas reducciones de costos son fundamentales para hacer de la alulosa una alternativa competitiva a los edulcorantes convencionales existentes en el mercado.
El rápido desarrollo de la conversión enzimática, la biología sintética y los sistemas de producción integrados está revolucionando la producción de alulosa.
Estas tecnologías no sólo aumentan la eficiencia y la escalabilidad de la producción de alulosa, sino que también están en línea con las tendencias mundiales hacia procesos de fabricación sostenibles y económicamente viables.
Las investigaciones futuras deberían seguir centrándose en mejorar la estabilidad y la actividad de las enzimas mediante técnicas avanzadas de diseño de proteínas.
Además, el descubrimiento de nuevos huéspedes microbianos y la optimización de sus vías metabólicas pueden mejorar aún más los sistemas de producción microbiana. La integración de sistemas de producción continua y el desarrollo de técnicas de procesamiento posteriores más eficientes serán clave para la viabilidad comercial de la alulosa.
La colaboración entre la industria y el mundo académico es esencial para convertir estos avances tecnológicos en aplicaciones prácticas.
Aprovechando la experiencia y los recursos de ambos sectores, será posible superar los desafíos que aún persisten en la producción de alulosa y explotar plenamente su potencial como alternativa de azúcar saludable y sostenible.
4. Conclusiones
La tendencia mundial en la producción de alulosa se caracteriza por un cambio hacia métodos biológicos sostenibles y eficientes.
Los actores clave están invirtiendo en tecnologías avanzadas para optimizar los procesos de producción, y China está haciendo una contribución significativa a través de sus inversiones en I+D y desarrollos tecnológicos.
La colaboración entre la industria y la academia es esencial para superar los desafíos de producción y satisfacer la creciente demanda mundial de alulosa.
Las recientes aprobaciones regulatorias, particularmente por parte de la FDA y la aprobación esperada por parte de la EFSA, aumentan aún más el potencial de mercado de la alulosa, lo que indica un futuro brillante para este innovador sustituto del azúcar.
Además, la reciente aprobación por parte de la Comisión Nacional de Salud de China aumenta significativamente el potencial del mercado interno de la alulosa, apoyando su integración en una amplia gama de alimentos y en línea con las tendencias de salud mundiales.

