Hallazgos recientes sobre las funciones fisiológicas y la biosíntesis de la D-alulosa
Allulose StoreFuente: fronteras
Microbiología de los alimentos
Volumen 13 - 2022 | https://doi.org/10.3389/fmicb.2022.881037
Este artículo es parte del tema de investigación ' Tecnologías microbianas innovadoras para una ciencia alimentaria futura y sostenible'
Hallazgos recientes sobre las funciones fisiológicas y la biosíntesis de la D-alulosa
- Laboratorio Clave de Química y Biotecnología de Carbohidratos, Ministerio de Educación, Facultad de Biotecnología, Universidad de Jiangnan, Wuxi, China
La D-alulosa, un azúcar generalmente reconocido como seguro (GRAS), es poco común en la naturaleza.
Su bajo contenido calórico, su sabor similar a la sacarosa y sus funciones únicas lo convierten en uno de los edulcorantes más prometedores para uso futuro.
La D-alulosa tiene muchos efectos fisiológicos, como efectos antiobesidad, antihiperglucemia, antidiabéticos, antiinflamatorios, antioxidantes y neuroprotectores.
Por lo tanto, la D-alulosa tiene un valor de aplicación importante en la industria alimentaria, la industria farmacéutica y la atención sanitaria.
Sin embargo, el alto costo de producción de D-alulosa limita su aplicación a gran escala. Actualmente, la biotransformación resulta muy atractiva para la síntesis de D-alulosa, siendo los dos métodos principales de biosíntesis la estrategia de Izumoring y la estrategia de la aldolasa dependiente de DHAP.
Este artículo revisa los últimos hallazgos sobre las funciones fisiológicas y la biosíntesis de la D-alulosa. También presenta las perspectivas futuras para su producción.
Introducción
Recientemente, el riesgo de obesidad, hiperlipidemia, hipertensión y diabetes ha aumentado rápidamente en todo el mundo debido a la ingesta excesiva de dietas nutritivas ricas en grasas y azúcar.
La sacarosa, un edulcorante alimentario tradicional, juega un papel importante en la industria alimentaria debido a su dulzura y palatabilidad ( Castro-Muñoz et al., 2022 ).
Sin embargo, la sacarosa tiene algunas desventajas, como su alto contenido calórico, su capacidad para inducir reacciones hiperglucémicas y diabetes ( Grassi et al., 2021 ).
Por lo tanto, los sustitutos de edulcorantes bajos en calorías han atraído el interés de los investigadores ( Khan et al., 2021 ).
Se han descrito más de 30 tipos de azúcares raros ( Granström et al., 2004 ). Estos poseen funciones biológicas únicas y se utilizan como aditivos alimentarios, supresores de células cancerosas y componentes básicos de fármacos anticancerígenos y antivirales ( Zhang et al., 2016b ; Li et al., 2017 ; Guerrero-Wyss et al., 2018 ; Hoshikawa et al., 2018 ; Xia et al., 2021 ).
La D -alulosa (también conocida como D-psicosa) es el más notable de los azúcares raros.
Han pasado más de 20 años desde que Ken Izumori informó por primera vez sobre la D-alulosa ( Itoh et al., 1995 ).
Tiene el 70% de su dulzura, pero sólo el 0,3% de su contenido energético, en forma de sacarosa.
Además, casi no contiene calorías ( Matsuo et al., 2002 ).
Como bioproducto de importancia industrial, la D-alulosa fue catalogada como sustancia “generalmente reconocida como segura” (GRAS) por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) en 2002 y aprobada para su uso en confitería, jugos de frutas, suplementos dietéticos y otros productos dietéticos.
Por lo tanto, la D-alulosa tiene un valor de aplicación importante en la industria alimentaria, la industria farmacéutica y la atención sanitaria.
Se espera que la D-alulosa cambie el mercado de edulcorantes debido a su bajo contenido calórico y palatabilidad, ya que podrá competir con otros sustitutos del azúcar (alcoholes de azúcar como xilitol, manitol y sorbitol).
Se espera que el precio comercial de la D-alulosa se acerque al de los edulcorantes sustitutos del azúcar competidores, como el xilitol (2–5 USD/kg), el manitol (1–5 USD/kg) y el sorbitol (1–10 USD/kg).
La D-alulosa será competitiva en la producción a gran escala en un futuro próximo, similar a otros edulcorantes con un consumo anual de millones de toneladas.
Actualmente, los factores que limitan la liberación y el precio de la D-alulosa incluyen el alto costo de los materiales de partida, los bajos rendimientos y la dificultad de aislamiento.
En este artículo, resumimos y analizamos hallazgos recientes sobre las funciones fisiológicas y la biosíntesis de la D-alulosa.
Funciones fisiológicas de la D-alulosa
El efecto de la D-alulosa sobre el metabolismo lipídico
Se ha demostrado que la D-alulosa tiene efectos antiobesidad en animales y humanos al reducir la ingesta de alimentos, la masa grasa y el peso del tejido adiposo ( Kimura et al., 2017 ; Bilal et al., 2018 ).
Además, varias líneas de evidencia sugieren que la D-alulosa puede aumentar el gasto energético y reducir la deposición de grasa en ratas normales ( Chung et al., 2012 ; Ochiai et al., 2014 ).
Aunque la D-alulosa puede reducir el peso del tejido adiposo, el mecanismo sigue siendo desconocido.
Puede reducir la actividad de la sintasa de ácidos grasos (FSA) y aumentar la actividad de la β-oxidación y la carnitina palmitoiltransferasa (CPT) en el tejido adiposo blanco epididimario (WAT; Han et al., 2016 ).
Además, la D-alulosa dietética puede inhibir la expresión de la acetil-CoA carboxilasa alfa (ACCα) relacionada con la lipogénesis en el tejido adiposo del epidídimo.
Además, la D-alulosa dietética puede estimular la expresión de la proteína quinasa alfa 2 activada por AMP (AMPKα2), relacionada con la oxidación de ácidos grasos, la lipasa sensible a hormonas (HSL) y el receptor alfa activado por el proliferador de peroxisomas (PPARα; Chen et al., 2019 ). Por lo tanto, la D-alulosa posee posibles propiedades antiobesidad .
Efecto antihiperglucémico de la D-alulosa
La mala nutrición ha provocado un rápido aumento de la incidencia de la obesidad y la diabetes tipo 2 relacionada con la obesidad (DM2) en todo el mundo, lo que aumenta significativamente los costos del tratamiento de estas enfermedades crónicas.
Por lo tanto, es fundamental identificar intervenciones terapéuticas eficaces para el tratamiento de la diabetes y sus complicaciones. La D-alulosa ha recibido mucha atención debido a sus prometedoras propiedades antihiperglucémicas, ya que puede regular los niveles plasmáticos de glucosa, el peso corporal y la masa grasa ( Matsuo e Izumori, 2009 ; Hossain et al., 2015 ; Lee et al., 2020 ).
Sin embargo, el mecanismo de su efecto antidiabético sigue siendo incierto. Se plantea la hipótesis de que la D-alulosa afecta los niveles de glucosa en sangre y la secreción de insulina, o la actividad de la glucosidasa y las enzimas lipolíticas.
Se ha demostrado que la D-alulosa inhibe significativamente el aumento de la concentración de glucosa plasmática inducido por sacarosa o maltosa ( Matsuo e Izumori, 2009 ).
Además, se ha demostrado que la D-alulosa inhibe eficazmente la actividad intestinal de la sacarasa y la maltasa.
La adición de D-alulosa (5 g) puede suprimir significativamente el aumento de glucosa en sangre inducido por maltodextrina oral (75 g) en adultos normales.
Además, la D-alulosa oral por sí sola no afecta los niveles de glucosa e insulina en sangre ( Iida et al., 2008 ).
También se ha demostrado que la D-alulosa inhibe la elevación de la glucosa en sangre posprandial, especialmente en pacientes con diabetes limítrofe, y no se observaron efectos secundarios ni problemas clínicos después de 12 semanas de ingesta continua de D-alulosa ( Hayashi et al., 2010 ).
Aunque varios estudios han demostrado que la D-alulosa tiene actividad antidiabética, el mecanismo aún no se comprende completamente.
En el hígado, el metabolismo de la D-glucosa está regulado por el desplazamiento nucleocitoplasmático de la glucoquinasa ( Hossain et al., 2015 ).
Con niveles bajos de glucosa, la glucoquinasa permanece inactiva unida a la proteína reguladora de la glucoquinasa (GKRP), que se recluta al núcleo del hepatocito. Cuando los niveles de glucosa alcanzan niveles altos, la glucoquinasa se activa por disociación del complejo glucoquinasa-GKRP y se transloca del núcleo al citoplasma, donde participa en el metabolismo del glucógeno y la homeostasis de la glucosa sanguínea ( Liu et al., 2012 ).
Por ejemplo, la activación de la glucoquinasa puede mejorar la tolerancia a la glucosa y la sensibilidad a la insulina ( Shintani et al., 2017b ).
La función alterada de la glucoquinasa hepática conduce a la patogénesis de la hiperglucemia en la diabetes ( Basu et al., 2001 ).
Por lo tanto, la glucoquinasa se considera un objetivo potencial para los fármacos antidiabéticos ( Lloyd et al., 2013 ).
Además, la glucoquinasa es activada por varios fosfatos de fructosa, como la fructosa-6-fosfato (F6P) y la fructosa-1-fosfato (F1P; Pfefferkorn, 2013 ).
La D-alulosa-1-fosfato, al igual que la fructosa-1-fosfato, también activa la glucoquinasa. Por lo tanto, la D-alulosa puede aumentar la utilización hepática de glucosa ( Toyoda et al., 2010 ).
La glucosa-6-fosfatasa (G6Pasa) contribuye a la hiperglucemia en la diabetes y regula los pasos que determinan la velocidad del flujo de gluconeogénesis hepática ( Herling et al., 1998 ).
La D-alulosa puede regular los niveles de azúcar en sangre y ejercer efectos hipolipidémicos al reducir la actividad de G6Pasa ( Nagata et al., 2015 ).
Se ha informado que la administración oral de D-alulosa puede estimular la secreción de GLP-1 y, por lo tanto, puede utilizarse para la prevención y el tratamiento de la intolerancia a la glucosa ( Hayakawa et al., 2018 ).
Recientemente se ha confirmado que la D-alulosa induce la liberación de GLP-1, activa la señalización aferente vagal, reduce la ingesta de alimentos y limita la hiperglucemia en ratas diabéticas sanas y obesas.
Además, la D-alulosa oral puede corregir la sobrealimentación arrítmica, la obesidad y la diabetes ( Iwasaki et al., 2018 ).
Otras funciones fisiológicas de la D-alulosa
La D-alulosa ejerce efectos antiinflamatorios al suprimir los niveles séricos de citocinas proinflamatorias como el factor de necrosis tumoral alfa (TNF-α), la interleucina-6 (IL-6) y la proteína quimioatrayente de monocitos 1 (MCP-1). Estas citocinas se derivan principalmente del tejido adiposo visceral ( Moller y Berger, 2003 ; Kim et al., 2017 ).
La D-alulosa también tiene efectos antioxidantes, protegiendo contra la apoptosis inducida por 6-hidroxidopamina o previniendo el daño testicular al eliminar las especies reactivas de oxígeno (ROS) ( Takata et al., 2005 ; Suna et al., 2007 ).
La D-alulosa también puede prolongar la vida útil al aumentar las actividades de la superóxido dismutasa (SOD) y la catalasa (CAT) ( Shintani et al., 2017a ).
Además, se ha demostrado que la D-alulosa altera los niveles de colesterol sérico en hámsteres, en parte al reducir los niveles de la proproteína convertasa subtilisina/kexina tipo 9 (Pcsk9) ( Kanasaki et al., 2019 ).
Además, la D-alulosa puede mejorar la sensibilidad a la insulina sistémica y muscular en ratas despiertas ( Natsume et al., 2021). Diversas funciones fisiológicas de la D-alulosa. ilustrado en la Figura 1 .
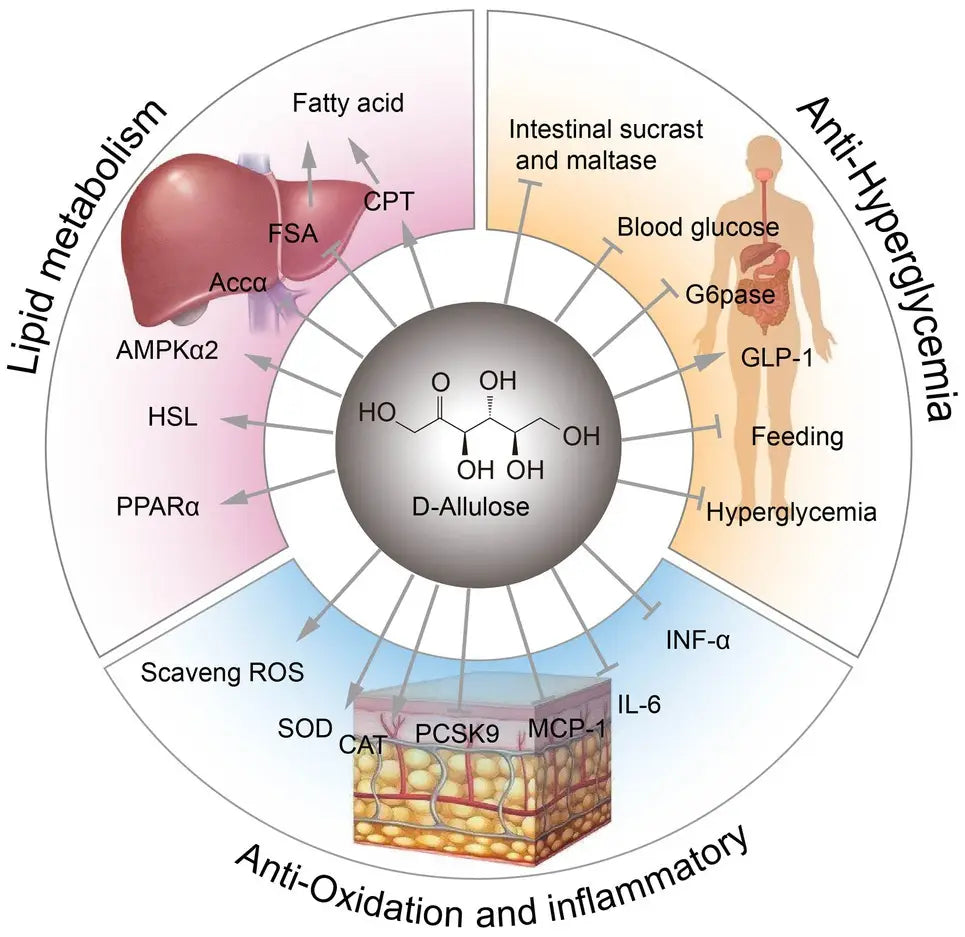
Figura 1. Funciones fisiológicas de la D-alulosa. FSA, sintasa de ácidos grasos; CPT, palmitoiltransferasa de carnitina; ACCα, acetil-CoA carboxilasa alfa; AMPKα, proteína quinasa alfa activada por AMP; HSL, lipasa sensible a hormonas; PPARα, receptor activado por el proliferador de peroxisomas alfa; ROS, especies reactivas de oxígeno; SOD, superóxido dismutasa; CAT, actividad de catalasa; Pcsk9, proproteína convertasa subtilisina/kexina tipo 9; MCP-1, proteína quimioatrayente de monocitos 1; G6Pasa, glucosa-6-fosfatasa.
Producción biológica de D-alulosa
Como se describió anteriormente, la D-alulosa posee numerosas funciones fisiológicas útiles. Sin embargo, es poco común en la naturaleza, lo que limita considerablemente su aplicación generalizada. La síntesis química tradicional de la D-alulosa suele implicar reacciones complejas y numerosas reacciones secundarias ( McDonald, 1967 ; Doner, 1979 ).
Es difícil producir una única configuración de producto utilizando métodos químicos.
Por el contrario, los enfoques de bioconversión tienen varias ventajas, incluidas condiciones de reacción suaves, pocos subproductos, pasos de purificación simples y propiedades respetuosas con el medio ambiente ( Zhang et al., 2021 ).
Por lo tanto, la biotransformación se ha convertido gradualmente en el método principal para la síntesis de D-alulosa.
Actualmente, la producción biológica de D-alulosa se logra principalmente mediante dos estrategias : (1) la estrategia Izumoring y (2) la estrategia de la aldolasa dependiente de DHAP.
Producción de D-alulosa mediante la estrategia Izumoring
Producción de D-alulosa a partir de D-fructosa utilizando enzimas de la familia D-tagatosa 3-epimerasa
La estrategia Izumoring es un enfoque prometedor para la bioproducción de cualquier azúcar hexosa e involucra D-tagatosa-3-epimerasas (DTEasas), poliol deshidrogenasas y aldosa isomerasas ( Izumori, 2006 ).
En las últimas décadas, la estrategia Izumoring ha demostrado ser eficaz en la biosíntesis de azúcares raros.
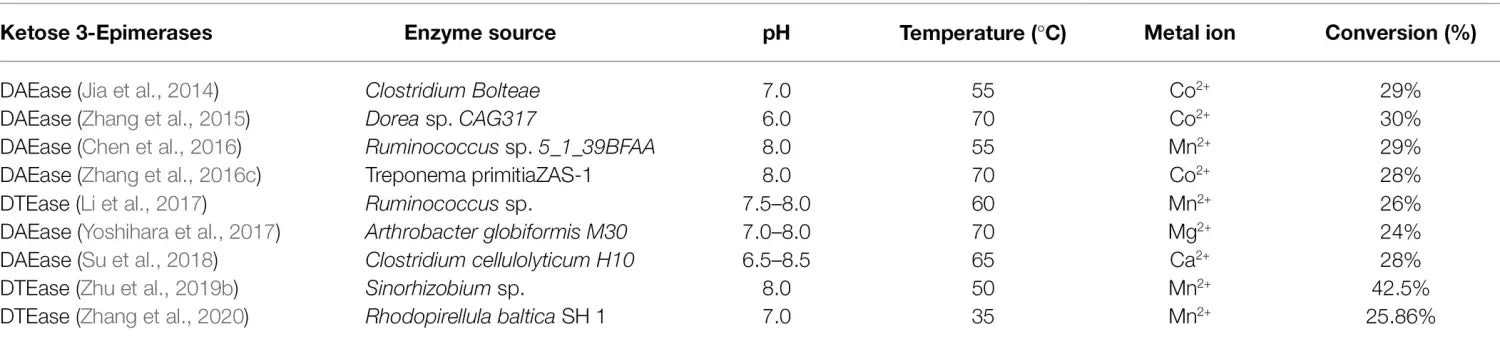
Las enzimas que pertenecen a la familia DTEase son enzimas clave para la biosíntesis de D-alulosa a partir de D-fructosa ( Figura 2 ), e incluyen DTEase y D-alulosa-3-epimerasa (DAEase).
La DAEase muestra una mayor especificidad para la D-alulosa que para la D-tagatosa ( Kim et al., 2006 ).
Desde la identificación de la primera DTEasa de Pseudomonas cichorii ST-24 en 1993, se han aislado otras enzimas DTEasa de diversas especies, como Agrobacterium tumefaciens ( Kim et al., 2006 ), Clostridium Bolteae ( Jia et al., 2014 ), Dorea sp. CAG317 ( Zhang et al., 2015 ), Ruminococcus sp. 5_1_39BFAA ( Chen et al., 2016 ), Treponema primitia ZAS-1 ( Zhang et al., 2016c ), Rhodobacter sphaeroides ( Qi et al., 2017 ), Ruminococcus sp. ( Li et al., 2018 ), Arthrobacter globiformis M30 ( Yoshihara et al., 2017 ), Clostridium cellulolyticum H10 ( Su et al., 2018 ), Sinorhizobium sp. ( Zhu et al., 2019b ), y Rhodopirellula baltica SH 1 ( Zhang et al., 2020 ). Los detalles de las propiedades catalíticas de las enzimas que pertenecen a la familia DTEase de diferentes especies se presentan en la Tabla 1 . Itoh et al. (1995) informaron por primera vez la inmovilización de DTEase de P. cichorii en perlas de quitoperla y produjeron 90 g de D-alulosa a partir de 500 g de D-fructosa.
Desde entonces, los métodos de inmovilización de DTEase han atraído un interés generalizado ( Lim et al., 2009 ; Tseng et al., 2014 ; Narayan Patel et al., 2018 ), y las enzimas inmovilizadas han mostrado una estabilidad térmica y una estabilidad de almacenamiento mejoradas.
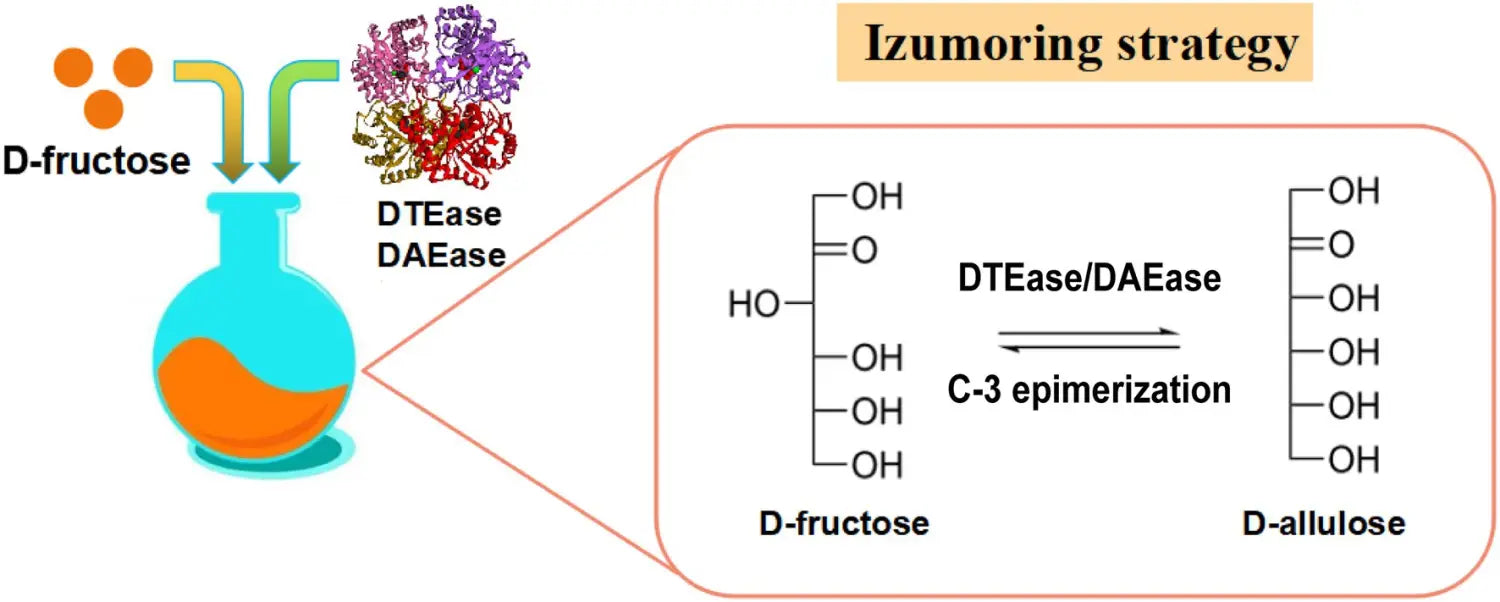
Figura 2. Estrategia de isomaltulosa para la producción de D-alulosa. DTEasa, D-tagatosa-3-epimerasa; DAEasa, D-alulosa-3-epima
Biosíntesis de D-alulosa a partir de materiales económicos basada en enzimas DTEasas
En la actualidad, los subproductos agrícolas, como los residuos de frutas y verduras, causan importantes problemas agrícolas ( Lai et al., 2017 ).
Los residuos agrícolas suelen enterrarse en vertederos o incinerarse ( Park y Yoon, 2015 ). Sin embargo, estos residuos contienen grandes cantidades de fibra dietética y azúcares, como sacarosa, D-glucosa y D-fructosa.
La conversión de fibras dietéticas y azúcares en productos de alto valor añadido es un paso importante para aliviar los problemas agrícolas.
La catálisis en cascada se considera un enfoque muy atractivo en comparación con la síntesis tradicional paso a paso.
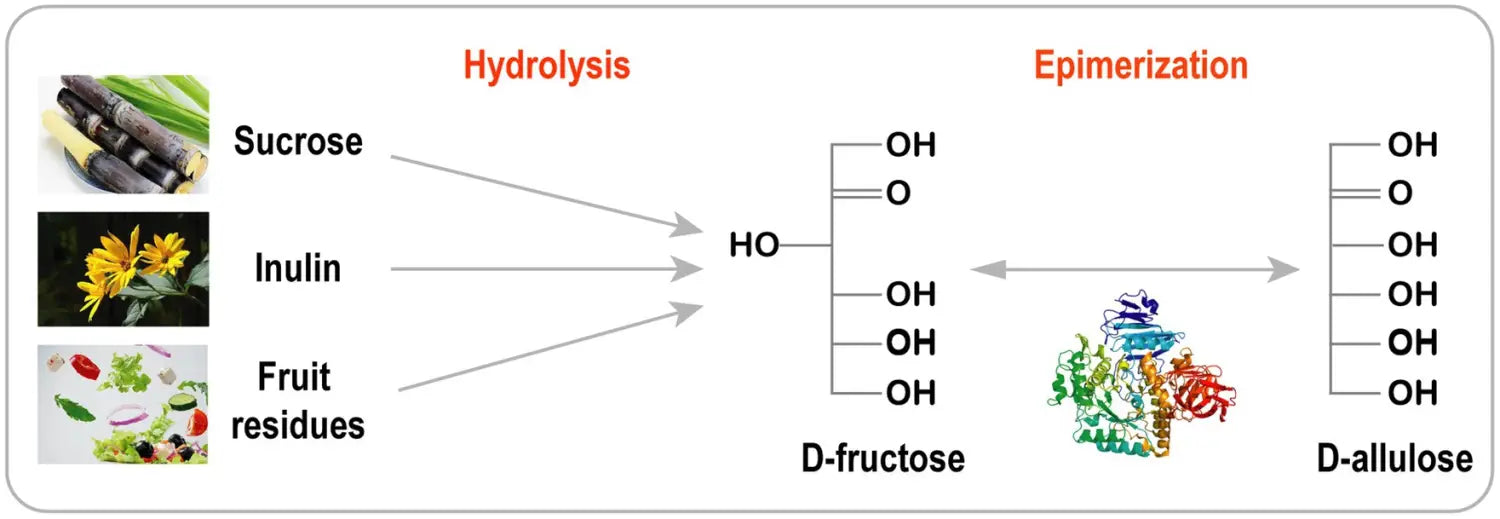
Esta estrategia se utiliza a menudo para producir azúcares raros a partir de materiales económicos como sacarosa, alcachofa de Jerusalén, inulina y residuos de frutas y verduras ( Figura 3 ; Wagner et al., 2015 ; Song et al., 2016 , 2017 ; Zhang et al., 2017 ; Yang et al., 2019 ; Li et al., 2020a ).
La D-alulosa se sintetizó eficientemente a partir de sacarosa utilizando invertasa recombinante purificada, D-xilosa isomerasa y DTEasa.
Además, se utilizó una integración práctica de cromatografía en cascada y de lecho móvil simulado (SMB) para producir D-alulosa pura (99,9 %) con un rendimiento muy alto (89 %; Wagner et al., 2015 ).
La D-alulosa también se puede sintetizar a través de una reacción en cascada de dos pasos que involucra la hidrólisis de la alcachofa de Jerusalén ( Song et al., 2017 ), residuos de plantas crucíferas ( Song et al., 2016 ) e inulina ( Li et al., 2020a ).
Para reducir los costos de producción y evitar la purificación de enzimas, Zhu y sus colaboradores desarrollaron un sistema de reacción de dos enzimas en un solo paso utilizando una nueva exoinulinasa derivada de Bacillus velezensis (BvInu) y con DAEase de Ruminococcus sp. para la producción de D-alulosa de alcachofa de Jerusalén.
BvInu y DAEase se expresaron en Bacillus subtilis y se secretaron al sobrenadante sin purificación. Con la proporción óptima de BvInu/RDAE (80:40 U/g de inulina), se obtuvieron 10,3 g/L de D-alulosa a partir de 50 g/L de inulina a 50 °C durante 2 h ( Zhu et al., 2020 ).
Biosíntesis de D-alulosa mediante microorganismos
En comparación con las reacciones en cascada de un solo paso, las reacciones biocatalíticas de células completas tienen varias ventajas ( Figura 4 ): (1) Las células que contienen enzimas se pueden preparar fácilmente sin una laboriosa purificación de enzimas; (2) el contexto celular proporciona un microambiente adecuado y regeneración de cofactores (ATP, NAD + /NADH); (3) las paredes celulares y las membranas protegen a las enzimas de las duras condiciones de reacción; y (4) la colocalización de múltiples enzimas dentro de las células aumenta la concentración local de enzimas y reduce la difusión de intermediarios en reacciones en cascada ( Wu y Li, 2018 ).
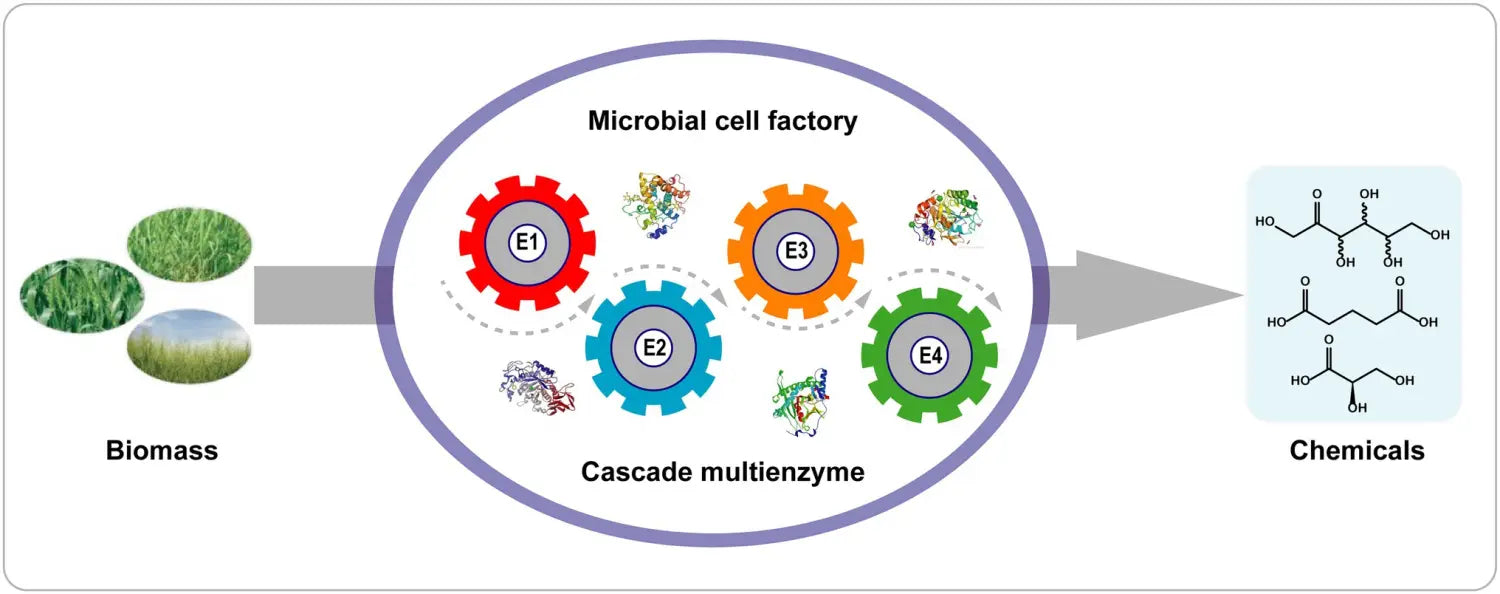
Figura 4. Biotransformación en cascada con una sola célula recombinante. E1–E4 indican las enzimas 1–4.
Escherichia coli modificada es uno de los organismos más comúnmente utilizados para la producción de D-alulosa, debido a su fondo limpio, rápida tasa de crecimiento, fácil cultivo y genética estable.
La DAEasa y la D-glucosa isomerasa (GIasa) de Acidothermus cellulolyticus se coexpresaron para producir D-alulosa a partir de D-glucosa ( Zhang et al., 2017 ).
De manera similar, la DAEasa y la xilosa isomerasa (XI) se coexpresaron para producir D-alulosa utilizando D-glucosa como sustrato ( Chen et al., 2017 ).
En los dos enfoques anteriores, la D-glucosa se convirtió primero en D-fructosa mediante GIase o XI, y luego la D-fructosa se isomerizó inmediatamente en D-alulosa mediante DAEase.
Si bien se logró una buena productividad mediante la manipulación de E. coli , lo cual no era aplicable en la industria alimentaria debido a las endotoxinas y a su clasificación como de grado no alimentario, hasta la fecha la DAEasa se ha expresado con éxito en varias cepas aptas para uso alimentario, como B. subtilis , Saccharomyces cerevisiae y Corynebacterium glutamicum ( Li et al., 2015b ; He et al., 2016 ). He et al. (2016) La DTEasa ATCC 35704 de Clostridium scindens se presentó en la superficie de las esporas de B. subtilis para producir D-alulosa a partir de D-fructosa. La DAEasa se unió al extremo C-terminal de CotZ y mostró una alta estabilidad térmica. Tras cinco ciclos de uso, se mantuvo el 60 % de la actividad ( He et al., 2016 ).
En nuestro estudio previo, desarrollamos una técnica de visualización superficial de esporas para la producción de D-alulosa a partir de D-glucosa. En este enfoque, la enzima clave XI de Thermus thermophilus y la DAEasa de A. tumefaciens se inmovilizaron en esporas de S. cerevisiae mediante métodos biológicos y químicos, respectivamente. Li y otros, 2015b ).
Además, se sobreexpresaron múltiples DAEasas e invertasa (INV) en C. glutamicum , y las células modificadas inmovilizadas con alginato se sometieron a una reacción en cascada en un sistema de reacción de uno y dos pasos para producir D-alulosa a partir de melaza de caña de azúcar. Tras 8 h de reacción, se obtuvieron 61,2 g/L de D-alulosa, lo que representa el 17,4 % del monosacárido total ( Yang et al., 2019 ).
Actualmente, la estrategia Izumoring es el principal método para la producción industrial de D-alulosa, que se puede lograr mediante SMB. Además, la D-fructosa separada puede reutilizarse para producir D-alulosa. En resumen, la estrategia Izumoring es la forma más sencilla y común de biosintetizar D-alulosa. Sin embargo, las limitaciones del equilibrio termodinámico constituyen un obstáculo que limita la aplicación generalizada de la D-alulosa en la industria alimentaria.
Producción de D-alulosa mediante aldolasas dependientes de DHAP
Como se mencionó anteriormente, se han desarrollado varios enfoques basados en la estrategia Izumoring para producir D-alulosa a partir de materiales de partida económicos como la alcachofa de Jerusalén, la inulina y los residuos agrícolas.
Sin embargo, la reacción catalizada por la enzima clave DAEasa es reversible y la tasa de conversión es baja, lo que resulta en un precio elevado de la D-alulosa resultante. Además, la mayoría de las cepas utilizadas en la síntesis de D-alulosa no son microorganismos GRAS.
Por lo tanto, es de suma importancia establecer una plataforma rentable y segura para la producción en masa de D-alulosa.
Las adiciones aldólicas estereoselectivas catalizadas por aldolasas se han convertido en una herramienta esencial en la síntesis asimétrica de CC ( Iturrate et al., 2010 ).
Entre los miembros de la familia de las aldolasas, las aldolasas dependientes de DHAP son las más utilizadas en la síntesis de muchos compuestos de carbohidratos que son difíciles de sintetizar mediante métodos químicos tradicionales ( Bosshart et al., 2013 ).
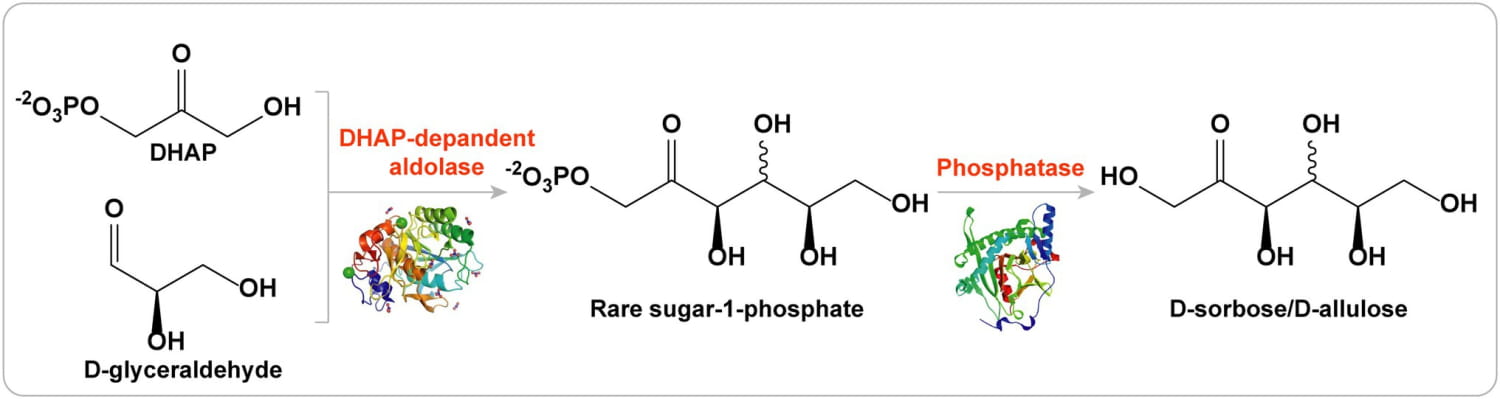
Hay cuatro tipos de aldolasas dependientes de DHAP: L-ramnulosa-1-fosfato aldolasa (RhaD), L-fuculosa-1-fosfato aldolasa (FucA), D-fructosa-1,6-bisfosfato aldolasa (FruA) y D-tagatosa-1,6-bisfosfato aldolasa (TagA).
Las reacciones aldólicas estereoselectivas de estas cuatro aldolasas son complementarias. En teoría, se puede producir un conjunto de cuatro cetosas utilizando DHAP como donante y el mismo aldehído como receptor ( Gustavo, 2000 ).
Por lo tanto, las aldolasas dependientes de DHAP son adecuadas para la síntesis de varios azúcares raros (incluidas D-alulosa, D-sorbosa, D-tagatosa y L-fructosa) debido a su estereoselectividad única ( Figura 5 ; Brovetto et al., 2011 ; Dai et al., 2021
Biosíntesis de D-alulosa por RhaD aldolasa, aceptor de D-gliceraldehído
Una desventaja importante de las estrategias de aldolasa dependientes de DHAP es que el sustrato donante, DHAP, es muy caro e inestable para la síntesis a gran escala ( Schümperli et al., 2007 ).
Sin embargo, existen diversas maneras de sintetizar DHAP mediante estrategias enzimáticas . Por ejemplo, la DHAP puede producirse mediante dihidroxiacetona (DHA), glicerol o glicerol-3-fosfato , o mediante vías metabólicas a partir de una materia prima económica como la glucosa o el glicerol ( Figura 6 ; Sánchez-Moreno et al., 2004 ; Li et al., 2012 , 2015a ; Wei et al., 2015 ; Yang et al., 2015 , 2016 ).
La E. modificada artificialmente. coli, la reacción aldólica catalizada por RhaD se utilizó para sintetizar azúcares raros (D-alulosa y D-sorbosa) utilizando glucosa como fuente de carbono y la adición continua de D-gliceraldehído al medio. Tras optimizar las condiciones de fermentación, el rendimiento aislado de D-alulosa y D-sorbosa fue de 0,21 mol/mol de D-gliceraldehído ( Wei et al., 2015). La D-alulosa y la D-sorbosa se consideran GRAS. Se produjo en la cepa C. glutamicum usando glucosa y D-gliceraldehído como materiales de partida. Se encontró que las cepas recombinantes de C. glutamicum que portaban RhaD y fructosa-1-fosfatasa (YqaB) acumulaban 19,5 g/L de D-sorbosa y 13,4 g/L de D-alulosa en la fermentación por lotes ( Yang et al., 2015 ). Además, se produjeron D-alulosa y D-sorbosa en una cepa recombinante de E. coli que sobreproduce RhaD y YqaB aldolasa por fermentación a partir de glicerol. Después de 15 h de fermentación, se determinaron las concentraciones de D-sorbosa (1,6 g/L) y D-alulosa (1,23 g/L) en el sobrenadante ( Li et al., 2015a ). Recientemente, nuestro grupo construyó un sistema eficiente para la síntesis en cascada de células completas de D-sorbosa y D-alulosa a partir de glicerol y D-gliceraldehído, que produjo 15,3 g/L de D-sorbosa y 6,4 g/L de D-alulosa durante la biotransformación por lotes ( Chen et al., 2020a ).
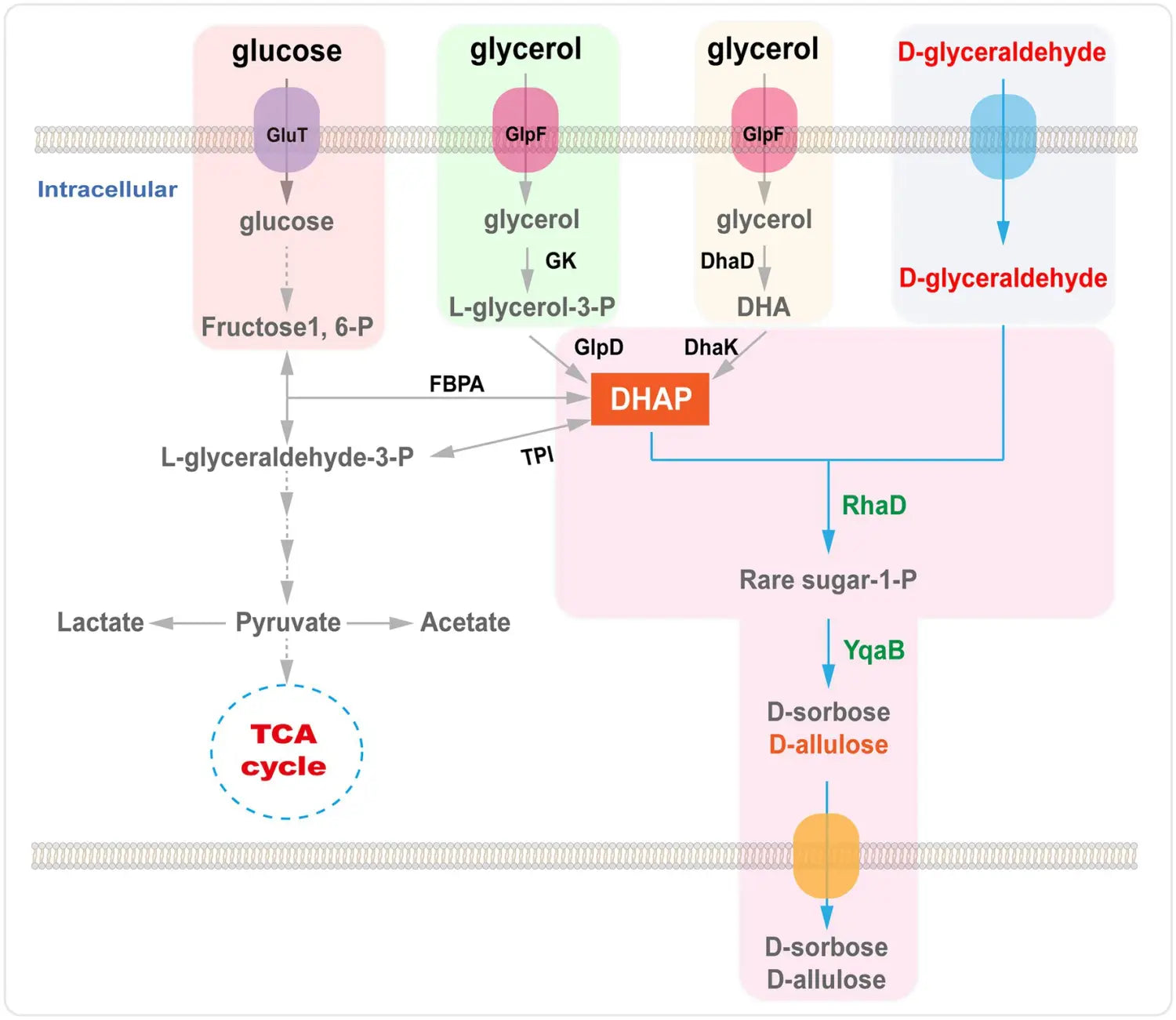
Figura 6. Biosíntesis de D-alulosa por la RhaD aldolasa a partir de glicerol o glucosa. GlpF, transportador de glicerol; GK, glicerol quinasa; GlpD, glicerol-3-fosfato deshidrogenasa; DhaD, glicerol deshidrogenasa; DhaK, dihidroxiacetona quinasas; FBPA, fructosa-1,6-difosfato aldolasa; TPI, triosa fosfato isomerasa; RhaD, L-ramnulosa-1-fosfato aldolasa; YqaB, fructosa-1-fosfatasa.
Biosíntesis de D-alulosa a partir de glicerol como único sustrato
Una plataforma microbiana basada en la aldolasa RhaD para la síntesis de D-alulosa sería prometedora para la producción a gran escala. El principal desafío radica en el alto costo del sustrato donante DHAP y de la molécula aceptora D-gliceraldehído. Afortunadamente, el problema de la acumulación de DHAP se ha solucionado mediante el uso del glicerol, un subproducto industrial de bajo costo, como fuente de carbono "verde". Por lo tanto, la siguiente pregunta es identificar una nueva enzima que convierta el glicerol de bajo valor en D-gliceraldehído. Se necesita una glicerol deshidrogenasa o glicerol oxidasa que pueda catalizar eficientemente la conversión de glicerol en D-gliceraldehído.
Para abordar este problema, nuestro grupo ha desarrollado una plataforma para la síntesis en cascada de células completas de D-sorbosa y D-alulosa utilizando glicerol como único sustrato. En este sistema ( Figura 7 ), el sustrato donante, DHAP, se genera a través de la vía de asimilación de glicerol, y la DHAP endógena se produce por sobreexpresión de la glicerol quinasa (GK) y la glicerol fosfato oxidasa (GPO) . El aceptor D-gliceraldehído se produce directamente a partir del glicerol por la alditol oxidasa de Streptomyces coelicolor A3 (AldO S.coe ). RhaD luego cataliza la reacción aldólica entre DHAP y D-gliceraldehído para producir la cetosa-1-fosfato correspondiente. Finalmente, la D-sorbosa y la D-alulosa se obtienen por eliminación del grupo fosfato por la fosfatasa YqaB. Con este sistema, los rendimientos de producción de D-sorbosa y D-alulosa aumentaron aproximadamente 1,7 y 1,2 veces, respectivamente, tras la sobreproducción de peroxidasa (PrxO2 o KatE) para eliminar los efectos perjudiciales del H₂O₂. Se obtuvo un total de 7,9 g/L de D-sorbosa y D-alulosa a partir de glicerol, con una tasa de conversión total del 17,7 % ( Chen et al., 2020b ).
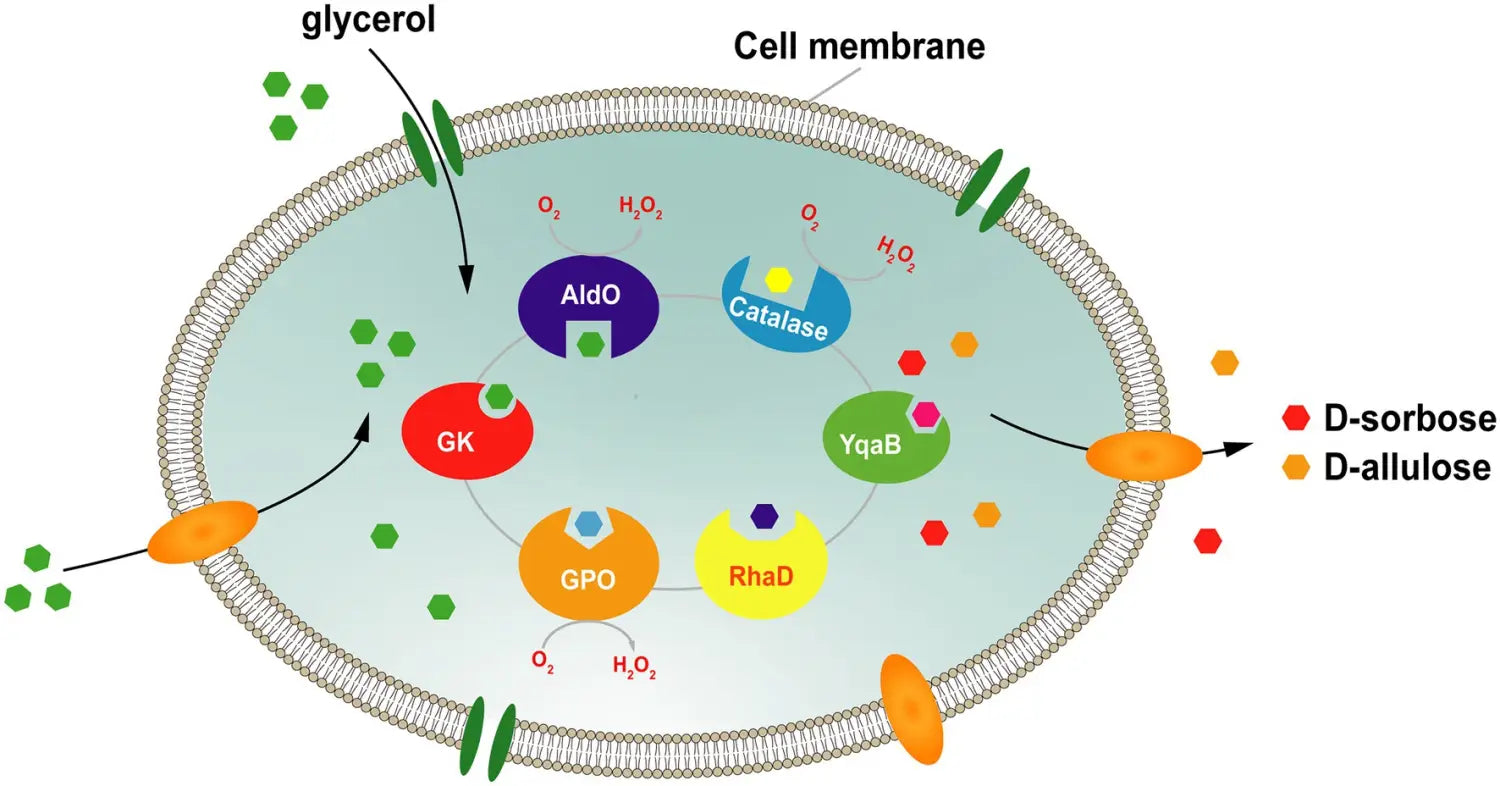
Figura 7. Estrategia para la síntesis celular total de D-sorbosa y D-alulosa a partir de glicerol. GK, glicerol quinasa; GPO, glicerol oxidasa; AldO; alditol oxidasa; RhaD, L-ramnulosa-1-fosfato aldolasa; YqaB, fructosa-1-fosfatasa.
Nuestro grupo también construyó un sistema multienzimático de un solo paso para la síntesis de D-sorbosa y D-alulosa a partir de glicerol como una única fuente de carbono ( Figura 8 ). Aquí, introdujimos la fosfatasa ácida PhoN (PhoN-Sf) de Shigella flexneri en el sistema en lugar de GK e YqaB, que catalizaron la reacción de fosforilación de glicerol en el primer paso y ayudaron a reciclar el fosfato de cetosa-1-fosfato en el último paso, proporcionando moléculas de azúcar raras libres. Se introdujo AldO S.coe en la cascada multienzimática anterior para sintetizar D-sorbosa y D-alulosa exclusivamente a partir del glicerol fácilmente disponible. Finalmente, se obtuvieron 14,8 g/L de D-sorbosa y D-alulosa a partir de glicerol ( Li et al., 2020b ). La estrategia anterior representa un enfoque muy útil y de bajo coste para la producción de varios otros azúcares raros también. En resumen, la biosíntesis de D-alulosa mediante fermentación basada en aldolasas dependientes de DHAP es muy prometedora. Sería más rentable construir una fábrica celular basada en la estrategia de aldolasas dependientes de DHAP para la síntesis de D-alulosa.
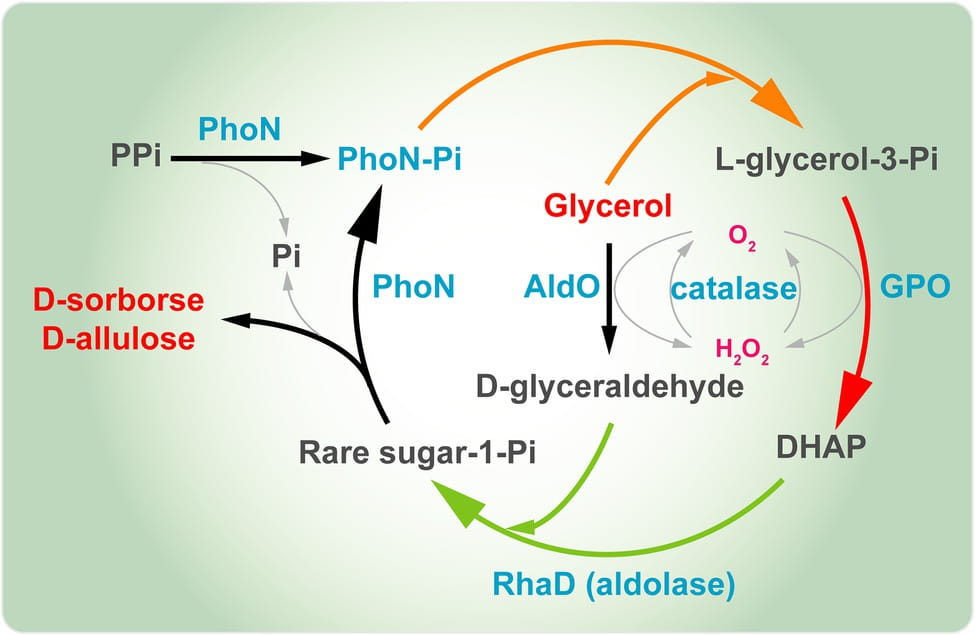
Figura 8. Síntesis multienzimática de D-sorbosa y D-alulosa a partir de glicerol. PhoN, fosfatasa ácida; GPO, glicerol oxidasa; AldO, alditol oxidasa; RhaD, L-ramnulosa-1-fosfato aldolasa; DHAP, dihidroxiacetona fosfato.
Producción controlada termodinámicamente de D-alulosa basada en una estrategia de fosforilación-desfosforilación
De hecho, las estrategias anteriores aún no pueden satisfacer la demanda de D-alulosa en la industria alimentaria. Por lo tanto, es interesante desarrollar una nueva estrategia para producir D-alulosa, que implica una bioproducción verde altamente eficiente y de bajo costo. Recientemente, You y sus colaboradores establecieron un biosistema enzimático sintético in vitro para producir D-alulosa a partir de almidón barato basado en la "estrategia impulsada termodinámicamente" ( Figura 9 ). Este biosistema in vitro incluía cinco enzimas principales, las reacciones proceden de la siguiente manera: (1) la maltodextrina (un derivado del almidón) se fosforiló para producir glucosa-1-fosfato (G1P) por la α-glucano fosforilasa (αGP) con fosfato como cosustrato. (2) La G1P se convirtió en glucosa-6-fosfato (G6P), que fue catalizada por la fosfoglucomutasa (PGM). (3) La G6P se convirtió en fructosa-6-fosfato (F6P), que fue catalizada por la fosfoglucosa isomerasa (PGI). (4) La epimerización de F6P resultó en la producción de D-alulosa-6-fosfato (A6P), que fue catalizada por la D-alulosa-6-fosfato 3-epimerasa (A6PE). (5) La desfosforilación de A6P resultó en la producción de D-alulosa y fosfato, que fue catalizada por la D-alulosa-6-fosfato fosfatasa (A6PP). Además, las otras cuatro enzimas auxiliares [isoamilasa (IA), 4-α-glucanotransferasa (4GT), polifosfato glucoquinasa (PPGK) y glucosa isomerasa (GI)] se añadieron al sistema de reacción en diferentes momentos para lograr la utilización completa de la maltodextrina para producir D-alulosa. En este biosistema, la energía de Gibbs de desfosforilación de A6P a D-alulosa es de -15,5 kJ/mol, que es irreversible, lo que indica que el paso de desfosforilación requerido para la producción de D-alulosa es termodinámicamente favorable y unidireccional para impulsar la reacción general hacia su finalización. Después de optimizar las condiciones de reacción, los rendimientos de producción de D-alulosa a partir de 10 y 50 g/L de almidón alcanzaron el 88,2% y el 79,2%, respectivamente ( Li et al., 2021 ). En general, esta estrategia impulsada termodinámicamente ofrece una alternativa prometedora para la producción rentable de D-alulosa. Dado que el sistema contiene múltiples enzimas y los pasos de purificación enzimática son engorrosos, la estrategia anterior aún no puede satisfacer las necesidades de industrialización.
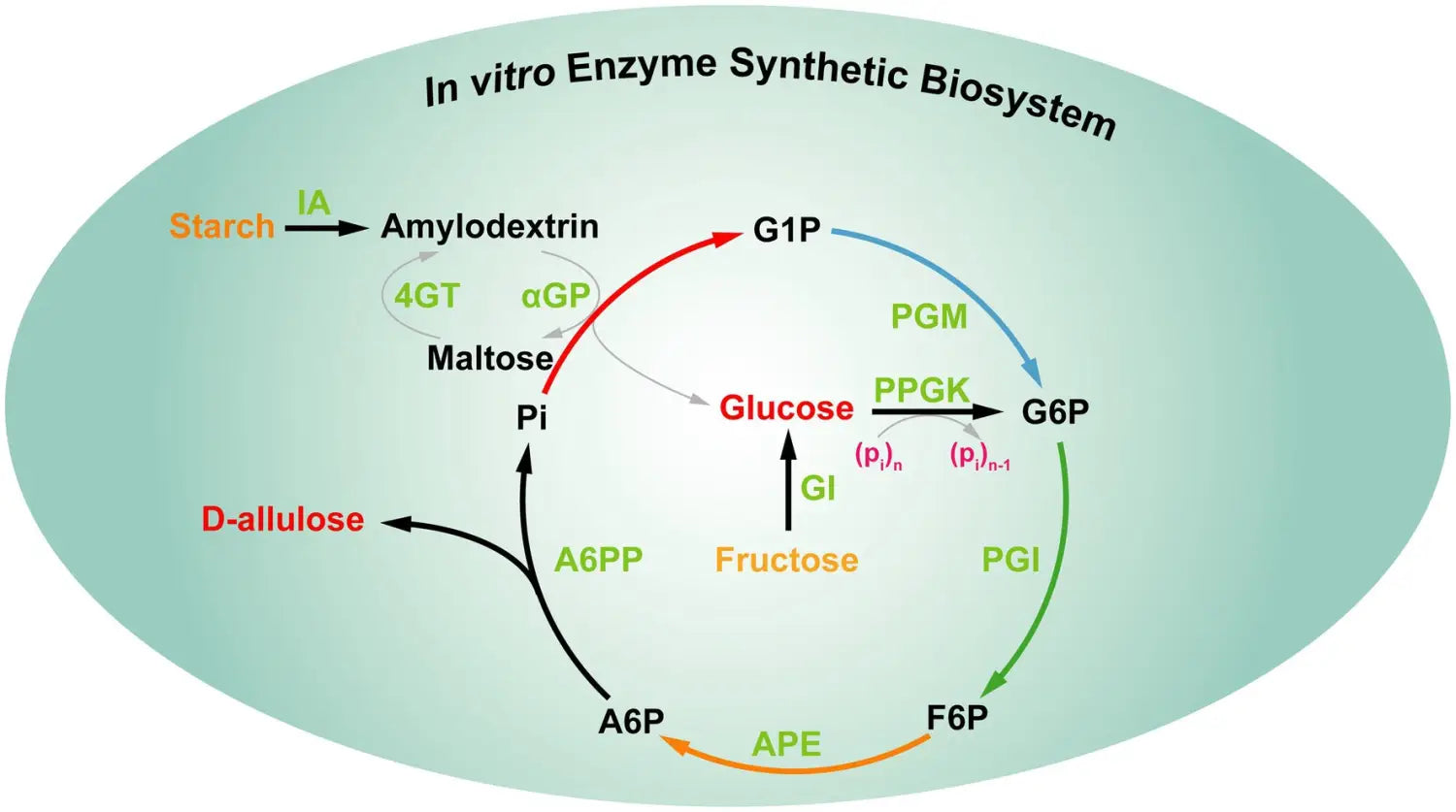
Figura 9. Síntesis multienzimática in vitro de D-alulosa a partir de almidón. IA, isoamilasa; 4GT, 4-α-glucanotransferasa; αGP, α-glucano fosforilasa; PGM, fosfoglucomutasa; PPGK, polifosfato glucoquinasa; PGI, fosfoglucosa isomerasa; GI, glucosa isomerasa; APE, D-alulosa-6-fosfato-3-epimerasa; A6PP, D-alulosa-6-fosfato fosfatasa; G1P, glucosa-1-fosfato; G6P, glucosa-6-fosfato; F6P, fructosa-6-fosfato; A6P, D-alulosa-6-fosfato.
Resumen y perspectivas futuras
El método más común para producir D-alulosa se basa en la estrategia Izumoring, que está limitada por el equilibrio termodinámico, lo que resulta en tasas de conversión bajas y costos sintéticos relativamente altos.
Por lo tanto, es necesario descubrir nuevas y robustas enzimas de la familia DTEasa. Además, se necesita la estrategia de evolución dirigida. ( Zhang et al., 2016a ; Zhu et al., 2019a ) o inmovilización enzimática ( Ran et al., 2019 ; Wong y otros, 2020 )
Mejorar el rendimiento catalítico de la DTEasa será muy útil. Para la estrategia de aldolasa dependiente de DHAP, la D-alulosa y la D-sorbosa se producen simultáneamente con RhaD, un aceptor de aldehído de D-glicerol. Se están utilizando diversas técnicas y métodos avanzados, incluida la evolución dirigida, para mejorar la estereoselectividad de las aldolasas ( d'Oelsnitz y Ellington, 2018 ). Shepelin y otros, 2018 ; Currin et al., 2021 ), técnicas de filtrado de alto rendimiento ( Ung et al., 2018 ; Rienzo et al., 2021 ) y la ingeniería racional ( Damborsky y Brezovsky, 2014 ; Windle y otros, 2014 ; Kim et al., 2020 ), se puede aplicar.
Es evidente que la estrategia termodinámica es un método prometedor para la producción de D-alulosa. Una dirección futura sería construir una fábrica de células microbianas utilizando este enfoque. Varias herramientas metabólicas, como CRISPR/Cas9, podrían contribuir a la producción industrial de D-alulosa. ( Wu et al., 2019 ; Nishida y Kondo, 2021 ), autoensamblaje ( Liu et al., 2019 ; Lange y Polizzi, 2021 ) y control dinámico ( Hartline et al., 2021 ; Zhu y otros, 2021 ).
Se espera que la D-alulosa sea asequible para el consumidor común en un futuro próximo.
Contribuciones de los autores
ZC se encargó del procesamiento de datos y la redacción, es decir, de la preparación del borrador original. X-DG participó en la visualización, la investigación y la supervisión. ZL se encargó de la redacción, la corrección y la edición. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este trabajo fue apoyado por la Fundación Nacional de Ciencias Naturales de China (n.os 32171475, 31971216), la Fundación de Ciencias Postdoctorales de China (n.o 2021M691285), el Proyecto de Innovación en Ciencia y Tecnología de la Provincia de Shandong (n.o 2019JZZY011006), la Fundación de Ciencias Naturales de la Provincia de Jiangsu (n.o BK20210465) y el Programa de Introducción Universitaria para Talentos Profesionales (n.o 111-2-06).
Incompatibilidad
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran considerarse un potencial conflicto de intereses.
Nota del editor
Todas las declaraciones realizadas en este artículo son responsabilidad exclusiva de los autores y no reflejan necesariamente las opiniones de sus organizaciones afiliadas, la editorial, los editores ni los revisores. La editorial no garantiza ni avala ningún producto reseñado en este artículo ni ninguna afirmación del fabricante.
Reconocimiento
Agradecemos a Zhou Xiaoman (Universidad de Jiangnan) por el dibujo.
Referencias
Basu, A., Basu, R., Shah, P., Vella, A., Johnson, CM, Jensen, M., et al. (2001). La diabetes tipo 2 altera la captación esplácnica de glucosa, pero no la absorción intestinal de glucosa durante la alimentación enteral: evidencia adicional de un defecto en la actividad de la glucoquinasa hepática. Diabetes. 50, págs. 1351–1362. doi: 10.2337/diabetes.50.6.1351
Bilal, M., Iqbal, HMN, Hu, H., Wang, W. y Zhang, X. (2018). Vías de ingeniería metabólica para la biosíntesis de azúcares raros, funcionalidades fisiológicas y aplicaciones: una revisión. Crítica Rev. Ciencias de la Alimentación Nutrición. 58, págs. 2768–2778. doi: 10.1080/10408398.2017.1341385
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Bosshart, A., Panke, S. y Bechtold, M. (2013). La optimización sistemática de las interacciones de la interfaz aumenta la termoestabilidad de una enzima multimérica. Angew. Química. Ed. Internacional. Engl. 52, págs. 9673–9676. doi: 10.1002/anie.201304141
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Brovetto, M., Gamenara, D., Méndez, PS, y Seoane, GA (2011). Liasas formadoras de enlaces CC en síntesis orgánica. Químico Rev. 111, 4346–4403. doi: 10.1021/cr100299p
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Castro-Muñoz, R., Correa-Delgado, M., Córdova-Almeida, R., Lara-Nava, D., Chávez-Muñoz, M., Velásquez-Chávez, VF, et al. (2022). Edulcorantes naturales: fuentes, extracción y usos actuales en alimentos e industrias alimentarias. Química alimentaria. 370:130991. doi: 10.1016/j.foodchem.2021.130991
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Chen, J., Huang, W., Zhang, T., Lu, M. y Jiang, B. (2019). Potencial antiobesidad de la D-psicosis azucarera rara mediante la regulación del metabolismo lipídico en ratas. Función alimentaria 10, 2417–2425. doi: 10.1039/c8fo01089g
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Chen, Z., Li, Z., Li, F., Wang, N. y Gao, X.-D. (2020b). Caracterización de la alditol oxidasa de Streptomyces coelicolor y su aplicación en la producción de azúcares raros. Bioorg. Med. Química. 28:115464. doi: 10.1016/j.bmc.2020.115464
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Chen, Z., Li, Z., Li, F., Wang, M., Wang, N. y Gao, X.-D. (2020a). Síntesis en cascada de cetosas raras por células completas basada en L-ramnulosa-1-fosfato aldolasa. Enzima. Microbio. Tecnología. 133:109456. doi: 10.1016/j.enzmictec.2019.109456
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Chen, X., Wang, W., Xu, J., Yuan, Z., Yuan, T., Zhang, Y., et al. (2017). Producción de D-psicosa a partir de D-glucosa mediante la coexpresión de D-psicosa 3-epimerasa y xilosa isomerasa. Enzima. Microbio. Tecnología. 105, págs. 18–23. doi: 10.1016/j.enzmictec.2017.06.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Chen, J., Zhu, Y., Fu, G., Song, Y., Jin, Z., Sun, Y., et al. (2016). Producción intra y extracelular de alto nivel de D-psicosa 3-epimerasa mediante un sistema de expresión inducible por xilosa modificado en Bacillus subtilis . J. Ind. Microbiol. Biotecnología. 43, 1577-1591. doi: 10.1007/s10295-016-1819-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Chung, YM, Hyun Lee, J., Youl Kim, D., Hwang, SH, Hong, YH, Kim, SB, et al. (2012). La D-psicosis dietética redujo la masa de grasa visceral en ratas con obesidad inducida por una dieta rica en grasas. J. Ciencia de los Alimentos. 77, H53–H58. doi: 10.1111/j.1750-3841.2011.02571.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Currin, A., Parker, S., Robinson, CJ, Takano, E., Scrutton, NS y Breitling, R. (2021). El arte evolutivo de crear diversidad genética: De la evolución dirigida a la biología sintética. Biotecnología. Adv. 50:107762. doi: 10.1016/j.biotechadv.2021.107762
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Dai, Y., Zhang, J., Jiang, B., Zhang, T. y Chen, J. (2021). Nueva estrategia para la biosíntesis de azúcares raros: reacciones aldólicas utilizando aldolasas dependientes de dihidroxiacetona fosfato (DHAP). Biología de los alimentos. 44:101377. doi: 10.1016/j.fbio.2021.101377
Damborsky, J., y Brezovsky, J. (2014). Herramientas computacionales para el diseño e ingeniería de enzimas. Curr. Opinión. Química. Biología. 19, págs. 8-16. doi: 10.1016/j.cbpa.2013.12.003
d'Oelsnitz, S., y Ellington, A. (2018). Evolución dirigida continua para la ingeniería de cepas y proteínas. Opinión Actual. Biotecnología. 53, 158–163. doi: 10.1016/j.copbio.2017.12.020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Doner, LW (1979). Isomerización de D-fructosa por base: evaluación cromatográfica líquida y aislamiento de D-psicosa. Res. de carbohidratos 70, págs. 209-216. doi: 10.1016/S0008-6215(00)87101-3
Granström, TB, Takata, G., Tokuda, M. y Izumori, K. (2004). Izumoring: Una estrategia novedosa y completa para la bioproducción de azúcares raros. J. Biosci. Bioing. 97, 89–94. doi: 10.1016/S1389-1723(04)70173-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Grassi, B., Onetto, MT, Zapata, Y., Jofré, P. y Echeverría, G. (2021). Dosis de sacarosa más baja versus estándar para el tratamiento de la hipoglucemia en pacientes con diabetes mellitus tipo 1 en terapia con bombas de insulina potenciadas con suspensión predictiva de glucosa baja (PLGS): un ensayo cruzado aleatorizado en Santiago, Chile. Diabetes Metab. Síndrome Clin. Gap. Puerto. 15, págs. 695–701. doi: 10.1016/j.dsx.2021.03.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Guerrero-Wyss, M., Durán Agüero, S. y Angarita Dávila, L. (2018). La D-Tagatosa es un edulcorante prometedor para controlar la glucemia: un nuevo alimento funcional. Res. Biomédica Int. 2018:8718053. doi: 10.1155/2018/8718053
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Gustavo, S. (2000). Reacciones enzimáticas de formación de enlaces CC en síntesis orgánica. Curr. Química Orgánica. 4, 283–304. doi: 10.2174/1385272003376283
Han, Y., Han, HJ, Kim, AH, Choi, JY, Cho, SJ, Park, YB, et al. (2016). La suplementación con D-alulosa normalizó el peso corporal y la masa de la almohadilla grasa en ratones obesos inducidos por la dieta a través de la regulación del metabolismo lipídico en condiciones de alimentación isocalórica. Mol. Nutrición. Res. Alimentaria. 60, 1695-1706. doi: 10.1002/mnfr.201500771
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Hartline, CJ, Schmitz, AC, Han, Y. y Zhang, F. (2021). Control dinámico en ingeniería metabólica: teorías, herramientas y aplicaciones. Ingeniería Metab. 63, 126-140. doi: 10.1016/j.ymben.2020.08.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Hayakawa, M., Hira, T., Nakamura, M., Iida, T., Kishimoto, Y. y Hara, H. (2018). La secreción de GLP-1, pero no de GIP, es estimulada potentemente por la D-alulosa (D-psicosa) luminal en ratas. Bioquímica. Biofísica. Brecha. Comun. 496, 898–903. doi: 10.1016/j.bbrc.2018.01.128
Hayashi, N., Iida, T., Yamada, T., Okuma, K., Takehara, I., Yamamoto, T., et al. (2010). Estudio sobre el efecto supresor de la glucemia posprandial de la psicosis D en la diabetes limítrofe y la seguridad de su ingestión a largo plazo en sujetos humanos normales. Biociencia. Biotecnología. Bioquímica. 74, págs. 510–519. doi: 10.1271/bbb.90707
He, W., Jiang, B., Mu, W. y Zhang, T. (2016). Producción de D-alulosa con D-psicosa 3-epimerasa expresada y mostrada en la superficie de Bacillus subtilis espora. J. Agric. Química alimentaria. 64, págs. 7201–7207. doi: 10.1021/acs.jafc.6b03347
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Herling, A. W., Burger, H.-J., Schwab, D., Hemmerle, H., Below, P. y Schubert, G. (1998). Perfil farmacodinámico de un nuevo inhibidor del sistema hepático de la glucosa-6-fosfatasa. Am. J. Phys. 274, G1087–G1093. doi: 10.2337/diabetes.47.5.85
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Hoshikawa, H., Kamitori, K., Indo, K., Mori, T., Kamata, M., Takahashi, T., et al. (2018). El tratamiento combinado con D-alosa, docetaxel y radiación inhibe el crecimiento tumoral en un modelo in vivo de cáncer de cabeza y cuello. Oncólogo Lett. 15, págs. 3422–3428. doi: 10.3892/ol.2018.7787
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Hossain, A., Yamaguchi, F., Matsuo, T., Tsukamoto, I., Toyoda, Y., Ogawa, M., et al. (2015). Azúcar raro D-alulosa: papel potencial y seguimiento terapéutico en el mantenimiento de la obesidad y la diabetes mellitus tipo 2. Farmaco. Terapeuta. 155, págs. 49–59. doi: 10.1016/j.pharmthera.2015.08.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Iida, T., Kishimoto, Y., Yoshikawa, Y., Hayashi, N., Okuma, K., Tohi, M., et al. (2008). La administración aguda de D-psicosis disminuye la respuesta glucémica a una prueba de tolerancia oral a la maltodextrina en adultos normales. J. Nutrición. Ciencias. Vitaminol. 54, págs. 511–514. doi: 10.3177/jnsv.54.511
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Itoh, H., Sato, T. e Izumori, K. (1995). Preparación de D-psicosa a partir de D-fructosa mediante D-tagatosa 3-epimerasa inmovilizada. J. Ferment. Bioing. 79, 184–185. doi: 10.1016/0922-338X(95)94091-5
Iturrate, L., Sánchez-Moreno, I., Oroz-Guinea, I., Pérez-Gil, J., y García-Junceda, E. (2010). Preparación y caracterización de una enzima aldolasa/quinasa bifuncional: un biocatalizador más eficiente para la formación de enlaces CC. Química 16, págs. 4018–4030. doi: 10.1002/chem.200903096
Iwasaki, Y., Sendo, M., Dezaki, K., Hira, T., Sato, T., Nakata, M., et al. (2018). La liberación de GLP-1 y la activación aferente vagal median los efectos metabólicos y cronoterapéuticos beneficiosos de la D-alulosa. Comunidad Nacional. 9:113. doi: 10.1038/s41467-017-02488-y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Izumori, K. (2006). Izumoring: una estrategia para la bioproducción de todas las hexosas. J. Biotecnología. 124, págs. 717–722. doi: 10.1016/j.jbiotec.2006.04.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Jia, M., Mu, W., Chu, F., Zhang, X., Jiang, B., Zhou, LL, et al. (2014). D-psicosa 3-epimerasa con pH neutro óptimo de Clostridium bolteae para la producción de D-psicosa: clonación, expresión, purificación y caracterización. Microbiol. Biotecnología Apl. 98, págs. 717–725. doi: 10.1007/s00253-013-4924-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Kanasaki, A., Jiang, Z., Mizokami, T., Shirouchi, B., Iida, T., Nagata, Y., et al. (2019). La D-alulosa altera los niveles séricos de colesterol en parte al reducir los niveles séricos de pcsk9 en hámsteres. Aterosclerosis 287:e201. doi: 10.1016/j.aterosclerosis.2019.06.611
Khan, SA, Verma, P., Ur Rahman, L. y Parasharami, VA (2021). Capítulo 13: Exploración de estudios biotecnológicos en edulcorantes bajos en calorías. Stevia rebaudiana : presente y perspectivas futuras”, en Plantas medicinales y aromáticas: ampliando sus horizontes a través de la ómica . ed. T. Aftab y KR Hakeem (Academic Press), págs. 289–324.
Kim, H.-J., Hyun, E.-K., Kim, Y.-S., Lee, Y.-J. y Oh, D.-K. (2006). Caracterización de un Agrobacterium tumefaciens D-psicosa 3-epimerasa que convierte la D-fructosa en D-psicosa. Aplicación. Medio ambiente. Microbiología. 72, págs. 981–985. doi: 10.1128/AEM.72.2.981-985.2006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Kim, S.-E., Kim, SJ, Kim, H.-J. y Sung, M.-K. (2017). La D-psicosa, un sustituto del azúcar, suprime la deposición de grasa corporal al alterar las redes de respuesta inflamatoria y el metabolismo lipídico en ratones C57BL/6J-ob/ob. J. Funct. Alimentos 28, 265–274. doi: 10.1016/j.jff.2016.11.029
Kim, T., Stogios, PJ, Khusnutdinova, AN, Nemr, K., Skarina, T., Flick, R., et al. (2020). Ingeniería racional de 2-desoxirribosa-5-fosfato aldolasas para la biosíntesis de (R)-1,3-butanodiol. J. Biol. Química. 295, 597–609. doi: 10.1074/jbc.RA119.011363
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Kimura, T., Kanasaki, A., Hayashi, N., Yamada, T., Iida, T., Nagata, Y., et al. (2017). La D-alulosa mejora la oxidación de grasas posprandial en humanos sanos. Nutrición 43–44, 16–20. doi: 10.1016/j.nut.2017.06.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Lai, WT, Khong, NMH, Lim, SS, Hee, YY, Sim, BI, Lau, KY, et al. (2017). Una revisión: subproductos agrícolas modificados para el desarrollo y la fortificación de alimentos y nutracéuticos. Tendencias Ciencia y tecnología alimentaria 59, 148–160. doi: 10.1016/j.tifs.2016.11.014
Lange, OJ, y Polizzi, KM (2021). Encajar o pegar: métodos covalentes y no covalentes para el autoensamblaje de proteínas. Opinión Actual. Biología Sistemática. 28:100374. doi: 10.1016/j.coisb.2021.100374
Lee, D., Han, Y., Kwon, EY y Choi, MS (2020). La D-alulosa mejora la disfunción metabólica en ratones C57BL/KsJ-db/db. Moléculas 25:3656. doi: 10.3390/molecules25163656
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Li, A., Cai, L., Chen, Z., Wang, M., Wang, N., Nakanishi, H., et al. (2017). Avances recientes en la síntesis de azúcares raros mediante aldolasas dependientes de DHAP. Res. de carbohidratos 452, 108-115. doi: 10.1016/j.carres.2017.10.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Li, Z., Cai, L., Wei, M. y Wang, PG (2012). Síntesis de cetosas en un solo paso con cuatro enzimas y fructosa 1,6-bisfosfato aldolasas de Estafilococo carnosus y músculo de conejo. Res. de carbohidratos 357, 143-146. doi: 10.1016/j.carres.2012.05.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Li, Z., He, B., Gao, Y. y Cai, L. (2015a). Síntesis de D-sorbosa y D-psicosa por vía recombinante. Escherichia coli . J. Carbohidr. Quím. 34, págs. 349–357. doi: 10.1080/07328303.2015.1068794
Li, Z., Li, F., Cai, L., Chen, Z., Qin, L. y Gao, X.-D. (2020b). Síntesis multienzimática en un solo paso de cetosas raras a partir de glicerol. J. Agric. Química alimentaria. 68, págs. 1347–1353. doi: 10.1021/acs.jafc.9b06748
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Li, Z., Li, Y., Duan, S., Liu, J., Yuan, P., Nakanishi, H., et al. (2015b). Bioconversión de D-glucosa a D-psicosa con D-xilosa isomerasa inmovilizada y D-psicosa 3-epimerasa en Saccharomyces cerevisiae espora. J. Ind. Microbiol. 42, págs. 1117–1128. doi: 10.1007/s10295-015-1631-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Li, C., Lin, J., Guo, Q., Zhang, C., Du, K., Lin, H., et al. (2018). Sobreexpresión secretora de D-psicosa 3-epimerasa, inmovilización y biotransformación, separación y cristalización de D-psicosa. J. Química. Tecnología. Biotecnología. 93, págs. 350–357. doi: 10.1002/jctb.5360
Li, Y., Shi, T., Han, P. y You, C. (2021). Producción termodinámica de D-alulosa de valor añadido a partir de almidón económico mediante un biosistema sintético enzimático in vitro. Catálogo ACS. 11, págs. 5088–5099. doi: 10.1021/accatal.0c05718
Li, W., Zhu, Y., Jiang, X., Zhang, W., Guang, C. y Mu, W. (2020a). Producción en un solo recipiente de D-alulosa a partir de inulina mediante una nueva exoinulinasa termoestable identificada de Aspergillus piperis y Dorea sp. D-alulosa 3-epimerasa. Bioquímica de procesos. 99, págs. 87–95. doi: 10.1016/j.procbio.2020.08.021
Lim, BC, Kim, HJ y Oh, DK (2009). Una D-psicosa 3-epimerasa inmovilizada estable para la producción de D-psicosa en presencia de borato. Bioquímica de procesos. 44, págs. 822–828. doi: 10.1016/j.procbio.2009.03.017
Liu, S., Ammirati, MJ, Song, X., Knafels, JD, Zhang, J., Greasley, SE, et al. (2012). Perspectivas sobre el mecanismo de activación de la glucoquinasa: observación de múltiples conformaciones proteicas distintas. J. Biol. Química. 287, 13598–13610. doi: 10.1074/jbc.M111.274126
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Liu, Z., Cao, S., Liu, M., Kang, W. y Xia, J. (2019). Nanoestructuras multienzimáticas autoensambladas en andamios proteicos sintéticos. Nano ACS 13, 11343–11352. doi: 10.1021/acsnano.9b04554
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Lloyd, DJ, St Jean, DJ, Kurzeja, RJ, Wahl, RC, Michelsen, K., Cupples, R., et al. (2013). Efectos antidiabéticos de los disruptores moleculares pequeños de la proteína reguladora de la glucoquinasa. Naturaleza 504, 437–440. doi: 10.1038/nature12724
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Matsuo, T., y Izumori, K. (2009). La D-psicosa inhibe la alfa-glucosidasa intestinal y suprime la respuesta glucémica después de la ingestión de carbohidratos en ratas. J. Clin. Biochem. Nutrición. 45, págs. 202–206. doi: 10.3164/jcbn.09-36
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Matsuo, T., Suzuki, H., Hashiguchi, M., e Izumori, K. (2002). La D-psicosa es un azúcar raro que no proporciona energía a las ratas en crecimiento. J. Nutrición. Ciencias. Vitaminol. 48, 77–80. doi: 10.3177/jnsv.48.77
Resumen de PubMed | Texto completo de CrossRef | Google Académico
McDonald, EJ (1967). Una nueva síntesis de D-psicosa (D-ribo-hexulosa). Res. de carbohidratos 5, 106–108. doi: 10.1016/0008-6215(67)85014-6
Moller, D., y Berger, J. (2003). Función de los PPAR en la regulación de la sensibilidad a la insulina y la inflamación relacionadas con la obesidad. Int. J. Obes. 27, T17-T21. doi: 10.1038/sj.ijo.0802494
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Nagata, Y., Kanasaki, A., Tamaru, S. y Tanaka, K. (2015). La D-psicosa, un epímero de la D-fructosa, altera favorablemente el metabolismo de los lípidos en ratas Sprague-Dawley. J. Agric. Química alimentaria. 63, págs. 3168–3176. doi: 10.1021/jf502535p
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Narayan Patel, S., Singh, V., Sharma, M., Sangwan, RS, Singhal, NK y Singh, SP (2018). Desarrollo de un nanobiocatalizador magnético termoestable y reciclable para el bioprocesamiento de residuos de procesamiento de frutas y la síntesis de D-alulosa. Tecnología de biorrecursos. 247, págs. 633–639. doi: 10.1016/j.biortech.2017.09.112
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Natsume, Y., Yamada, T., Iida, T., Ozaki, N., Gou, Y., Oshida, Y., et al. (2021). Investigación de los efectos de la D-alulosa en la resistencia a la insulina inducida por una dieta rica en sacarosa mediante pinzas hiperinsulinémicas-euglucémicas en ratas. Heliyón 7:e08013. doi: 10.1016/j.heliyon.2021.e08013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Nishida, K. y Kondo, A. (2021). Tecnologías de edición genómica derivadas de CRISPR para ingeniería metabólica. Ingeniería Metab. 63, págs. 141-147. doi: 10.1016/j.ymben.2020.12.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ochiai, M., Onishi, K., Yamada, T., Iida, T. y Matsuo, T. (2014). La D-psicosa aumenta el gasto energético y disminuye la acumulación de grasa corporal en ratas alimentadas con una dieta alta en sacarosa. Int. J. Ciencias de la Alimentación. Nutrición. 65, 245–250. doi: 10.3109/09637486.2013.845653
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Park, SY, y Yoon, KY (2015). Producción enzimática de fibra dietética soluble a partir de la fracción de celulosa de residuos de col china y su posible uso como fuente de alimento funcional. Ciencia de los Alimentos. Biotecnología. 24, págs. 529–535. doi: 10.1007/s10068-015-0069-0
Pfefferkorn, JA (2013). Estrategias para el diseño de activadores hepatoselectivos de la glucoquinasa para el tratamiento de la diabetes tipo 2. Experto. Opinión. Fármaco. Descubrimiento. 8, págs. 319–330. doi: 10.1517/17460441.2013.748744
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Qi, Z., Zhu, Z., Wang, J.-W., Li, S., Guo, Q., Xu, P., et al. (2017). Análisis bioquímico y caracterización cristalográfica preliminar de la D-tagatosa 3-epimerasa de Rhodobacter sphaeroides . Fábricas de células microbianas 16:193. doi: 10.1186/s12934-017-0808-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ran, G., Tan, D., Zhao, J., Fan, F., Zhang, Q., Wu, X., et al. (2019). Nanoesferas de polihidroxialcanoato funcionalizadas como biocatalizador estable para la producción rentable del azúcar raro D-alulosa. Tecnología de biorrecursos. 289:121673. doi: 10.1016/j.biortech.2019.121673
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Rienzo, M., Jackson, SJ, Chao, LK, Leaf, T., Schmidt, TJ, Navidi, AH, et al. (2021). Cribado de alto rendimiento para la biosíntesis de moléculas pequeñas de alta eficiencia. Ingeniería Metab. 63, 102-125. doi: 10.1016/j.ymben.2020.09.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sánchez-Moreno, I., Francisco García-García, J., Bastida, A., y García-Junceda, E. (2004). Sistema multienzimático para la formación de enlaces C–C catalizada por aldolasa dependiente de dihidroxiacetona fosfato a partir de dihidroxiacetona. Química Común. 35, 1634–1635. doi: 10.1002/chin.200447149
Schümperli, M., Pellaux, R. y Panke, S. (2007). Rutas químicas y enzimáticas para el fosfato de dihidroxiacetona. Microbiol. Biotecnología Apl. 75, 33–45. doi: 10.1007/s00253-007-0882-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Shepelin, D., Hansen, ASL, Lennen, R., Luo, H. y Herrgård, MJ (2018). Selección de los mejores: ingeniería evolutiva de la producción química en microbios. Genes 9:249. doi: 10.3390/genes9050249
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Shintani, T., Sakoguchi, H., Yoshihara, A., Izumori, K. y Sato, M. (2017a). La D-alulosa, un estereoisómero de la D-fructosa, extiende la vida útil de Caenorhabditis elegans a través de un mecanismo de restricción dietética: un nuevo candidato a mimético de restricción dietética. Bioquímica. Biofísica. Brecha. Comun. 493, 1528-1533. doi: 10.1016/j.bbrc.2017.09.147
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Shintani, T., Yamada, T., Hayashi, N., Iida, T., Nagata, Y., Ozaki, N., et al. (2017b). Un jarabe de azúcar raro que contiene D-alulosa, pero no jarabe de maíz de alta fructosa, mantiene la tolerancia a la glucosa y la sensibilidad a la insulina, en parte mediante la translocación hepática de glucoquinasa en ratas Wistar. J. Agric. Química alimentaria. 65, págs. 2888–2894. doi: 10.1021/acs.jafc.6b05627
Song, Y., Nguyen, QA, Wi, SG, Yang, J. y Bae, HJ (2016). Estrategia para la producción dual de bioetanol y D-psicosa como productos de valor añadido a partir de residuos de vegetales crucíferos. Tecnología de biorrecursos. 223, 34–39. doi: 10.1016/j.biortech.2016.10.021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Song, Y., Oh, C. y Bae, H.-J. (2017). Producción simultánea de bioetanol y D-psicosa de valor añadido a partir de tubérculos de alcachofa de Jerusalén (Helianthus tuberosus L.). Tecnología de biorrecursos. 244, págs. 1068–1072. doi: 10.1016/j.biortech.2017.08.079
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Su, L., Sun, F., Liu, Z., Zhang, K. y Wu, J. (2018). Producción altamente eficiente de Clostridium cellulolyticum H10 D-psicosa 3-epimerasa en Bacillus subtilis y el uso de estas células para producir D-psicosis. Fábricas de células microbianas 17:188. doi: 10.1186/s12934-018-1037-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Suna, S., Yamaguchi, F., Kimura, S., Tokuda, M. y Jitsunari, F. (2007). Efecto preventivo de la D-psicosa, una de las cetohexosas raras, sobre la lesión testicular inducida por di-(2-etilhexil) ftalato (DEHP) en ratas. Toxicol. Lett. 173, 107–117. doi: 10.1016/j.toxlet.2007.06.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Takata, MK, Yamaguchi, F., Nakanose, K., Watanabe, Y., Hatano, N., Tsukamoto, I., et al. (2005). Efecto neuroprotector de la D-psicosis sobre la apoptosis inducida por 6-hidroxidopamina en células de feocromocitoma de rata (PC12). J. Biosci. Bioing. 100, págs. 511–516. doi: 10.1263/jbb.100.511
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Toyoda, Y., Mori, S., Umemura, N., Futamura, N., Inoue, H., Hata, T., et al. (2010). Supresión de los niveles de glucosa en sangre por D-psicosa en la prueba de tolerancia a la glucosa en ratas diabéticas. Japón. Farmacia. Ther. 65, págs. 2888–2894. doi: 10.1021/acs.jafc.6b05627
Tseng, C.-W., Liao, C.-Y., Sun, Y., Peng, C.-C., Tzen, JTC, Guo, R.-T., et al. (2014). Inmovilización de Clostridium cellulolyticum D-psicosa 3-epimerasa sobre cuerpos oleosos artificiales. J. Agric. Química alimentaria. 62, págs. 6771–6776. doi: 10.1021/jf502022w
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ung, YT, Ong, CE y Pan, Y. (2018). Enfoques actuales de alto rendimiento para el cribado de los efectos moduladores de los xenobióticos sobre las enzimas del citocromo P450 (CYP). Alto rendimiento. 7:29. doi: 10.3390/ht7040029
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Wagner, N., Bosshart, A., Failmezger, J., Bechtold, M. y Panke, S. (2015). Una reacción en cascada con separación integrada para superar las limitaciones termodinámicas en la síntesis de azúcares raros. Angew. Química. Ed. Internacional. Engl. 54, págs. 4182–4186. doi: 10.1002/anie.201411279
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Wei, M., Li, Z., Li, T., Wu, B., Liu, Y., Qu, J., et al. (2015). Transformación de la reacción en matraz en síntesis celular: producción de moléculas polihidroxiladas mediante ingeniería. Escherichia coli . Catálogo ACS. 5, págs. 4060–4065. doi: 10.1021/accatal.5b00953
Windle, CL, Müller, M., Nelson, A. y Berry, A. (2014). Ingeniería de aldolasas como biocatalizadores. Curr. Opinión. Química. Biología. 19, 25–33. doi: 10.1016/j.cbpa.2013.12.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Wong, JX, Ogura, K., Chen, S. y Rehm, BHA (2020). Polihidroxialcanoatos bioingenierizados como andamios enzimáticos inmovilizados para aplicaciones industriales. Frente. Bioing. Biotecnología. 8:156. doi: 10.3389/fbioe.2020.00156
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Wu, Y., Chen, T., Liu, Y., Tian, R., Lv, X., Li, J., et al. (2019). Diseño de circuitos genéticos programables con biosensor CRISPRi para el control dual dinámico y autónomo del flujo metabólico en Bacillus subtilis . Ácidos nucleicos Res. 48, págs. 996-1009. doi: 10.1093/nar/gkz1123
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Wu, S., y Li, Z. (2018). Biotransformaciones en cascada de células completas para síntesis orgánica multietapa en un solo paso. Química CatChem 10, págs. 2164-2178. doi: 10.1002/cctc.201701669
Xia, Y., Cheng, Q., Mu, W., Hu, X., Sun, Z., Qiu, Y., et al. (2021). Avances en la investigación de la D-alulosa: Una visión general de las funciones fisiológicas, las tecnologías de biotransformación enzimática y los procesos de producción. Alimento 10:2186. doi: 10.3390/foods10092186
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Yang, J., Tian, C., Zhang, T., Ren, C., Zhu, Y., Zeng, Y., et al. (2019). Desarrollo de un sistema de expresión de grado alimentario para la preparación de D-alulosa 3-epimerasa con genes de isoenzimas en tándem. Corynebacterium glutamicum y su aplicación en la conversión de melaza de caña a D-alulosa. Biotecnología. Bioing. 116, págs. 745–756. doi: 10.1002/bit.26909
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Yang, J., Zhu, Y., Li, J., Men, Y., Sun, Y. y Ma, Y. (2015). Biosíntesis de cetosas raras mediante la construcción de una vía de recombinación en un genoma modificado. Corynebacterium glutamicum . Biotecnología. Bioing. 112, 168–180. doi: 10.1002/bit.25345
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Yang, J., Zhu, Y., Men, Y., Sun, S., Zeng, Y., Zhang, Y., et al. (2016). Construcción de caminos en Corynebacterium glutamicum y la ingeniería de cepas para producir azúcares raros a partir de glicerol. J. Agric. Química alimentaria. 64, págs. 9497–9505. doi: 10.1021/acs.jafc.6b03423
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Yoshihara, A., Kozakai, T., Shintani, T., Matsutani, R., Ohtani, K., Iida, T., et al. (2017). Purificación y caracterización de la D-alulosa 3-epimerasa derivada de Arthrobacter globiformis M30, un microorganismo GRAS. J. Biosci. Bioing. 123, 170-176. doi: 10.1016/j.jbiosc.2016.09.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Zhang, W., Chen, D., Chen, J., Xu, W., Chen, Q., Wu, H., et al. (2021). D-alulosa, un azúcar raro y versátil: avances y desafíos biotecnológicos recientes. Crítica Rev. Ciencias de la Alimentación Nutrición. doi: 10.1080/10408398.2021.2023091
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Zhang, W., Jia, M., Yu, S., Zhang, T., Zhou, L., Jiang, B., et al. (2016a). Mejora de la termoestabilidad y la eficiencia catalítica de la D-psicosa 3-epimerasa de Clostridium bolteae ATCC BAA-613 utilizando mutagénesis dirigida al sitio. J. Agric. Química alimentaria. 64, págs. 3386–3393. doi: 10.1021/acs.jafc.6b01058
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Zhang, W., Li, H., Jiang, B., Zhang, T. y Mu, W. (2017). Producción de D-alulosa a partir de D-glucosa por Escherichia coli células transformantes que coexpresan los genes de D-glucosa isomerasa y D-psicosa 3-epimerasa. J. Sci. Agricultura Alimentaria. 97, págs. 3420–3426. doi: 10.1002/jsfa.8193
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Zhang, W., Li, H., Zhang, T., Jiang, B., Zhou, L. y Mu, W. (2015). Caracterización de una D-psicosa 3-epimerasa de Dorea sp. CAG317 con un pH ácido óptimo y una alta actividad específica. J. Mol. Catal. B Enzima. 120, págs. 68–74. doi: 10.1016/j.molcatb.2015.05.018
Zhang, J., Xu, C., Chen, X., Ruan, X., Zhang, Y., Xu, H., et al. (2020). Ingeniería Bacillus subtilis gen que alberga la D-tagatosa 3-epimerasa para la bioconversión de D-fructosa en D-psicosa a través de la fermentación. Enzima. Microbio. Tecnología. 136:109531. doi: 10.1016/j.enzmictec.2020.109531
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Zhang, W., Yu, S., Zhang, T., Jiang, B. y Mu, W. (2016b). Avances recientes en D-alulosa: funcionalidades fisiológicas, aplicaciones y producción biológica. Tendencias Ciencia y tecnología alimentaria 54, págs. 127-137. doi: 10.1016/j.tifs.2016.06.004
Zhang, W., Zhang, T., Jiang, B. y Mu, W. (2016c). Caracterización bioquímica de una D-psicosa 3-epimerasa de Treponema primitia ZAS-1 y su aplicación en la producción enzimática de D-psicosa. J. Sci. Agricultura Alimentaria. 96, págs. 49–56. doi: 10.1002/jsfa.7187
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Zhu, Z., Gao, D., Li, C., Chen, Y., Zhu, M., Liu, X., et al. (2019a). Rediseño de una nueva D-alulosa 3-epimerasa de Estafilococo áureo para la termoestabilidad y la producción biocatalítica eficiente de D-alulosa. Fábricas de células microbianas 18:59. doi: 10.1186/s12934-019-1107-z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Zhu, Z., Li, C., Liu, X., Gao, D., Wang, X., Tanokura, M., et al. (2019b). Caracterización bioquímica y aplicación biocatalítica de una nueva D-tagatosa 3-epimerasa de Sinorhizobium es. Abogado RSC. 9, 2919–2927. doi: 10.1039/C8RA10029B
Zhu, Y., Li, Y., Xu, Y., Zhang, J., Ma, L., Qi, Q., et al. (2021). Desarrollo de biosensores bifuncionales para la detección y el control dinámico del flujo de glucólisis en ingeniería metabólica. Ingeniería Metab. 68, págs. 142-151. doi: 10.1016/j.ymben.2021.09.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: azúcares raros, D-alulosa, D-alulosa 3-epimerasa, biosíntesis, aldolasas, aplicaciones
Referencia: Chen Z, Gao XD y Li Z (2022) Hallazgos recientes sobre las funciones fisiológicas y la biosíntesis de la D-alulosa. Front. Microbiol . 13:881037. doi: 10.3389/fmicb.2022.881037
Recibido: 22 de febrero de 2022; Aceptado: 11 de marzo de 2022;
Publicado: 14 de abril de 2022.
Revisado por:
Youqiang Xu , Universidad de Tecnología y Negocios de Beijing, China;Xinqiang Xie , Academia de Ciencias de Guangdong, China.
Copyright © 2022 Chen, Gao y Li. Este artículo es de acceso abierto y se distribuye bajo los términos de la Licencia Creative Commons Atribución-CompartirIgual (CC BY) . Se permite su uso, distribución y reproducción en otros foros, siempre que se cite al autor original y al titular de los derechos de autor, y se cite la publicación original en la revista, de acuerdo con las prácticas académicas aceptadas. Queda prohibido cualquier uso, distribución o reproducción que no cumpla con estos términos.
*Correspondencia: Zijie Li, lizijie@jiangnan.edu.cn
Descargo de responsabilidad: Todas las declaraciones realizadas en este artículo son responsabilidad exclusiva de los autores y no reflejan necesariamente las opiniones de sus organizaciones afiliadas, la editorial, los editores ni los revisores. La editorial no garantiza ni avala ningún producto reseñado en este artículo ni ninguna afirmación del fabricante.

 Zhou Chen
Zhou Chen  Xiao-Dong Gao
Xiao-Dong Gao